近期,北京工业大学城市建设学部杨艳玲研究员课题组研究成果在国际环境科学与生态学著名期刊《Science of The Total Environment》上发表。研究者利用潮汐流人工湿地系统,研究了异养硝化-好氧反硝化细菌(HN-AD)添加如何影响微生物群落和代谢途径,为其在分散式生活污水处理中的工程应用提供了理论基础。
本研究中,天昊生物提供了宏基因组测序及生信分析服务。在恭喜客户的同时,也让我们来简单看下这篇文章。

英文题目:Multi-metabolism regulation insights into nutrients removal performance with adding heterotrophic nitrification-aerobic denitrification bacteria in tidal flow constructed wetlands
中文题目:潮汐流人工湿地中添加异养硝化-好氧反硝化细菌对营养物质去除性能的多代谢调控研究
期刊名:Science of The Total Environment
添加HN-AD细菌可提高潮汐流人工湿地中氮和磷的去除率。
nirA和gltD基因受到激活,导致NH4+-N直接去除。
多代谢模型突出了糖酵解途径的glk、gap2和PK基因。
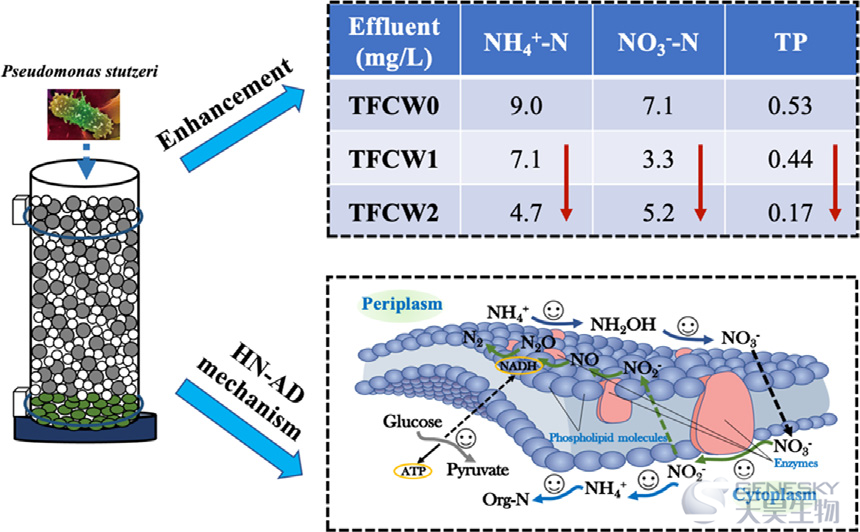

在分散式生活污水处理中,人工湿地(CWs)通常表现出功能冗余和微生物群落多样性的局限性,导致营养物质去除性能较低。为了解决这一难题,在开发用于脱氮除磷的潮汐流CWs (TFCWs)中加入异养硝化-好氧反硝化细菌(HN-AD)。加入HN-AD细菌后,与对照系统(总氮TN: 53.9%;总磷TP:83.9%)相比,TFCWs去除率更高,分别为TN:66.9%-70.1%和TP:88.2%-92.4%。在稳定运行期间。典型循环变化表明,在水力停留时间(HRT)为14 h和8 h的条件下,添加HN-AD细菌的TFCWs分别促进了NO3--N和NH4+-N的去除,并有少量NO2--N积累。活性氧化铝(AA)与HN-AD菌联用降低了磷的释放,缓解了其在CWs中去除性能差的问题。根据宏基因组分类群和功能注释,假单胞菌和自养硝化细菌在TFCWs脱氮中起着关键作用。此外,8 h-HRT的梯度毒性环境促进了异养硝化细菌和自养硝化细菌的共存。可能通过提高硝化和反硝化相关基因(如amoABC、hao、napA和nirS基因)加速NH4+-N转化。同时,HN-AD菌的加入刺激了氮同化过程的nirA和gltD基因,可能导致NH4+-N的直接去除。HN-AD过程调控多代谢的概念模型强调了glk、gap2和PK基因在糖酵解途径中的重要性,它们是营养代谢的重要驱动力。总的来说,该研究提供了关于正在进行的HN-AD细菌添加如何影响微生物群落和代谢途径的见解,为其在分散式生活污水处理中的工程应用提供了理论基础。
来自中国农村地区、城市郊区或旅游胜地的分散式污染源仍然存在,高达90%的未经处理的废水被不加区别地直接排放到附近的地表。与城市地区不同,这些地区的污水往往营养成分含量较低。然而,广泛的分布和复杂的地形通常是收集和净化分散生活污水的主要挑战。因此,建造“小规模”的污水处理厂是不现实的,因为运营和维护成本很高。人工湿地被认为是一种有前途的绿色技术,可以直接处理生活污水。但生物量增长缓慢、溶解氧(DO)不足、CWs吸附能力低,通常导致总氮和总磷去除效果较差。
近年来,异养硝化和好氧反硝化(HN-AD)技术在强化污染物去除方面引起了众多研究者的关注。然而,在分散式生活污水处理中,添加HN-AD菌用于提高营养物质去除率的研究很少。
关于HN-AD的代谢途径和清除机制,在解释氮转化方面仍然存在差异。基于HN-AD过程,还没有对微生物营养转化的结构和功能变化构建全面的见解。宏基因组分析是一种通过对环境样本中的总DNA进行测序的精确且与无需培养的方法。该方法可以更详细地评估复杂代谢途径、功能基因和关键酶对污染物转化的响应。因此,在不同的HRT下,通过在TFCWs中添加HN-AD,宏基因组分析可以基于天然微生物群的变化提供足够的测序深度。
本研究构建了三组TFCWs (TFCW 0、TFCW1和TFCW2),分别代表了在14 h-HRT下不添加HN-AD菌的TFCW、在14 h-HRT下添加HN-AD菌的TFCW和在8 h-HRT下添加HN-AD菌的TFCW。这项工作的目的是: (1)研究污染物在整个运行过程中的去除性能,探索典型循环中氮和磷的变化;(2)通过宏基因组分析确定微生物组结构和功能细菌的变化;(3)揭示氮、磷和糖酵解代谢途径及其相互关系。在此基础上,提出了在TFCWs中添加HN-AD菌的工程意义和潜在的营养去除机理。
从公司购买分离的HN-AD菌株,以制备在TFCWs中添加HN-AD细菌的制剂。设置了六个TFCWs (三组×两重复)。自动控制系统并行运行三套TFCWs(图1),该系统由一个水箱、一个进水泵、排水阀、液位传感器和一个出水泵组成。
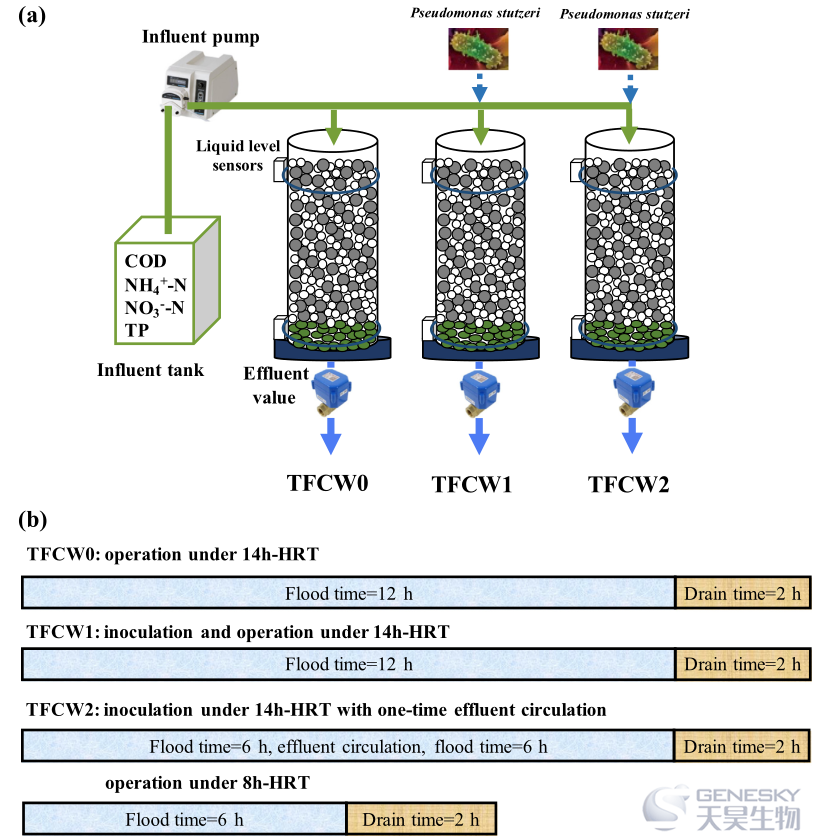
图1、TFCW0、TFCW1、TFCW2的实验装置(a)和操作流程(b)。
使用分光光度法测定了化学需氧量(COD)、NH4+-N、NO2--N、NO3--N和TN的浓度。测量溶解氧(DO)、酸碱度和温度。采用单因素方差分析和皮尔逊相关分析评价TFCW0、TFCW1和TFCW2的差异。
在第81天,从每个TFCW的顶部、中部和底部位置收集微生物样品。这三个样品被混合到一个单独的样品中,以避免物种分布的异质性,并确保宏基因组分析有足够的DNA。生物膜样品送天昊生物公司进行宏基因组测序。

图2描述了TFCW0、TFCW1和TFCW2在81天运行期间的各种污染物的去除性能。与TFCW1和TFCW2相比,TFCW0显示出显著更高的平均化学需氧量排放浓度。HN-AD菌的加入明显加速了有机物的降解,理论上可能促进了N的去除。NO3--N、NH4+-N和是出水TFCW0的主要TN种类(图2b和c)。检测到较少量的NO2--N,平均总氮去除效率为53.87%。可以推测,溶解氧不足和可用碳量不足都限制了总氮的转化和最终去除。总的来说,通过接种HN-AD菌可以更快地构建TFCW,并在长期运行中表现出对有机物和营养物的高效去除。
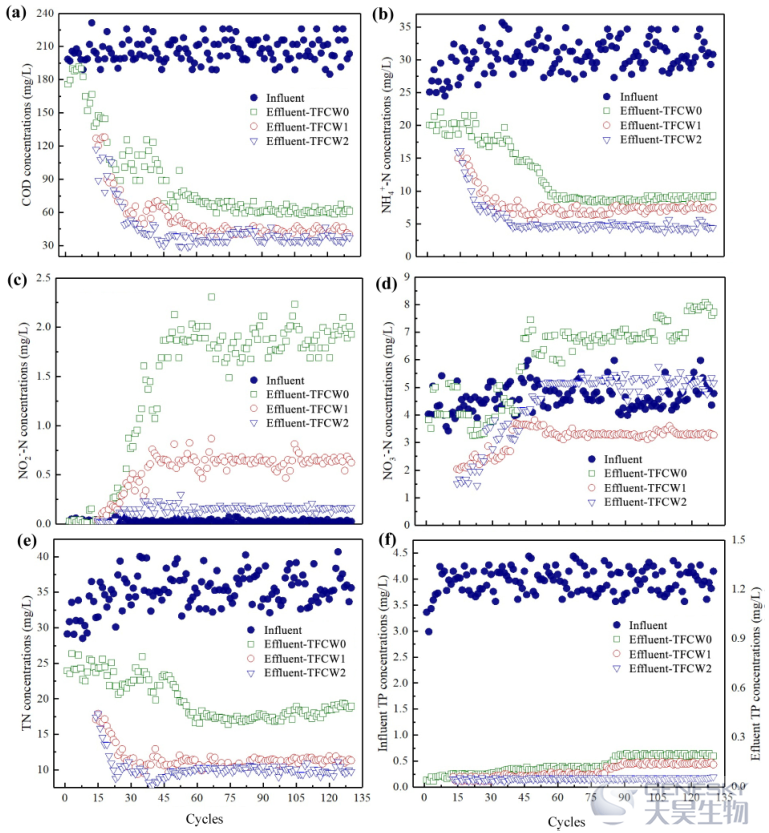
图2、试验期间TFCW0、TFCW1和TFCW2的去除性能: (a) COD; (b) NH4+-N; (c) NO2--N; (d) NO3--N; (e) TN; (f) TP。
如图3所示,NH4+-N的去除主要发生在梯度氧化过程中(TFCW0和TFCW1前6 h,TFCW2前4 h)。在TFCW0中,NH4+-N在缺氧过程中逐渐稳定,高于TFCW1和TFCW2。考虑到进水溶解氧控制在同一水平,在TFCW1和TFCW2中添加HN-AD菌可提高氨氮转化率。此外,TFCW2中的接触时间为6小时/周期,这比TFCW1 (12小时/周期)创造了更好的毒性环境。随着接触时间的延长,pH值的下降在最初的2 h内更为迅速,随后逐渐变缓。总体而言,与TFCW0和TFCW1相比,TFCW2最终获得了最佳的NH4+-N去除率。
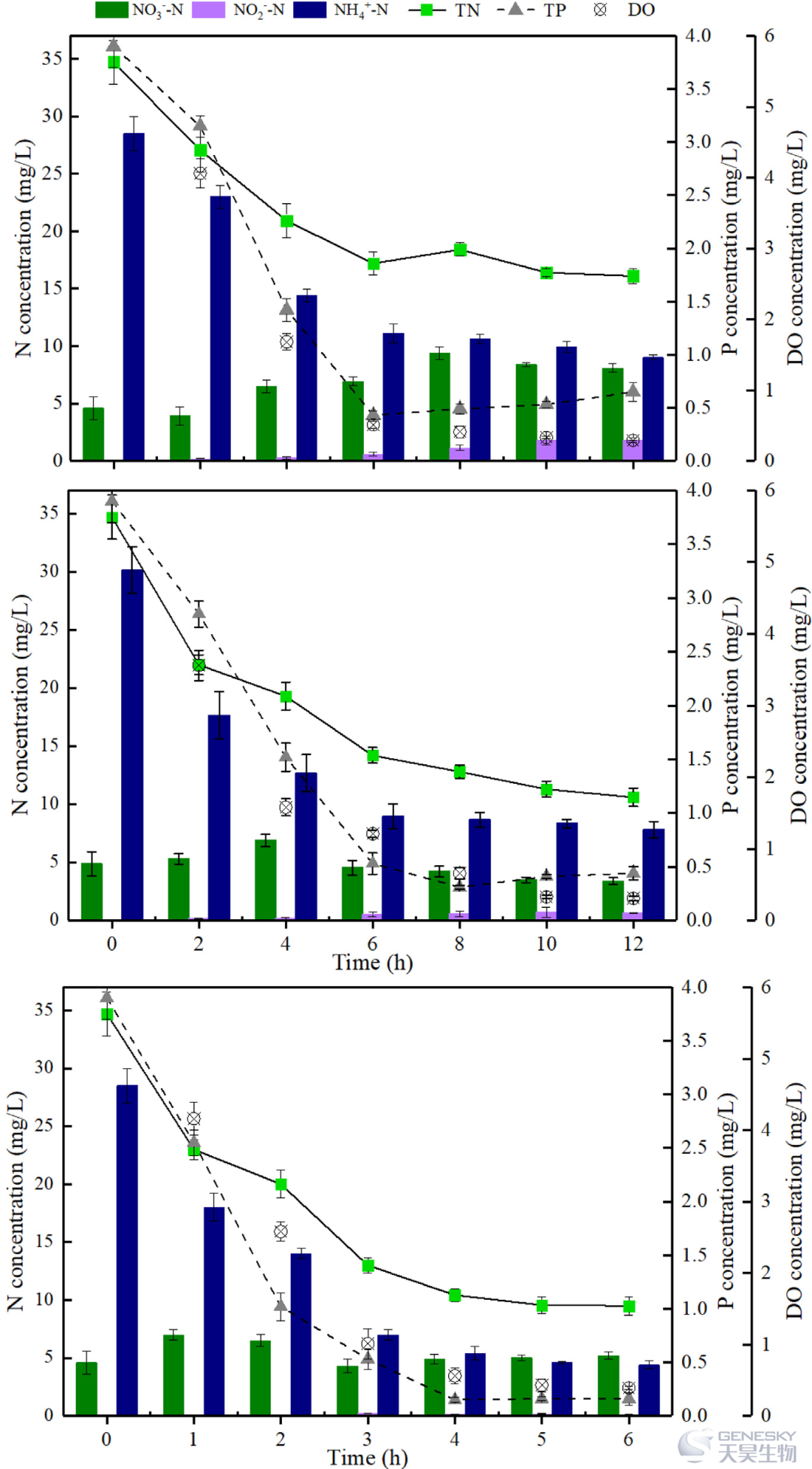
图3、TFCWs典型潮汐周期内NH4+-N、NO2-N、NO3-N、TN、TP和DO的动态变化。
在TFCW0、TFCW1和TFCW2中,总磷在梯度氧化过程中被迅速去除。经过梯度好氧工艺后,在6 h缺氧过程中,TFCW0和TFCW1中约有0.15 mg/L的磷被释放。然而,在最终出水浓度为0.16 mg/L时,TFCW2没有表现出明显的磷释放,说明较长的缺氧环境(TFCW0和TFCW1中的6 h)增加了磷的释放,削弱了TFCW的去除性能。
根据以上结果,在TFCWs中添加HN-AD菌可获得良好的脱氮除磷性能,尤其是在较好的梯度氧化(TFCW2)下。因此,我们进行了宏基因组分析,以阐明假单胞菌和HRT对TFCWs中微生物群落结构和微生物代谢功能的影响。在对照NCBI NR数据库搜索后,共有135,688,946 (TFCW0)、99,617,318 (TFCW1)和123,960,230 (TFCW2)个有效读序被归入推定分类组,其中细菌占99.21% (TFCW0)、99.43% (TFCW1)和99.36% (TFCW2),其次是古细菌(TFCW0: 0.18%、TFCW1: 0.09TFCW0: 0.21%)。
对三种TFCWs生物膜的微生物群落组成和系统发育结构进行分析发现,变形杆菌门是三个TFCW中最具优势的门,随着HN-AD细菌的加入,变形杆菌门的数量显著增加。对属级微生物群落的演替,进一步调查了前30个优势属(图4a)。在3个TFCWs中,Thauera属、Acidovorax属和Hydrogenophaga属均为优势属,相对丰度> 5%。总的来说,假单胞菌和索氏菌属是两种最主要的反硝化菌,它们可能在TFCWs的高效脱氮中起着关键作用。
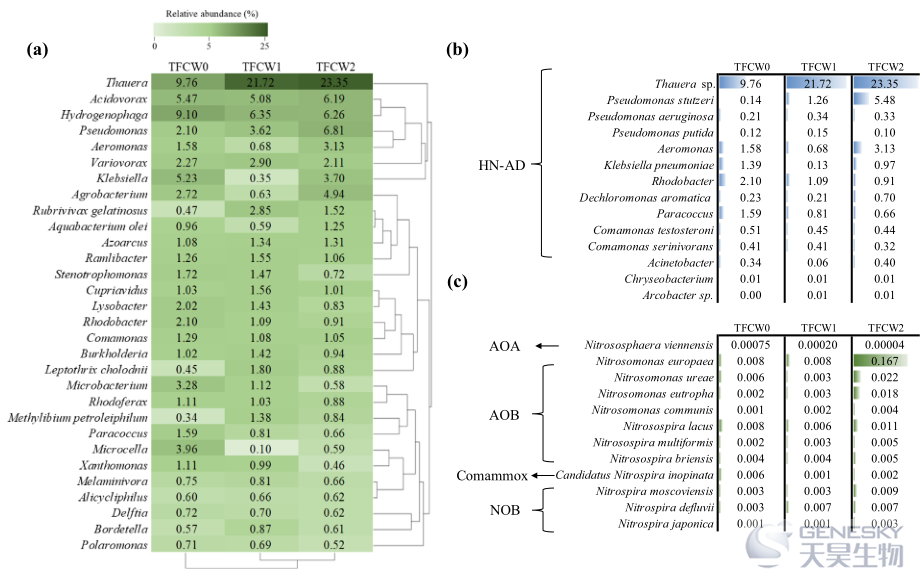
图4、三个TFCWs的细菌群落组成:(a)前30个优势属(至少一个样品的相对丰度> 0.5%);(b)和(c)分别在与氨转化相关的物种水平上的异养和自养硝化细菌。
在本研究中NH4+-N是进水中的主要氮污染。进一步研究了与硝化作用相关的功能细菌(HN-AD和自养硝化细菌)的动力学(图4b)。在微生物群落中占据稀有位置的TFCW0中,本土假单胞菌仅占0.14%。TFCW1和TFCW2分别大幅上升至1.26%和5.48%。对于氨氧化,有欧洲亚硝基单胞菌和亚硝基双孢菌,是本研究中主要的自养氨氧化细菌(AOB)(图4c)。
为了揭示TFCWs中生物膜的功能概况,应用eggNOG和KEGG数据库来注释总读序的类别。根据基于COG注释的功能分类(图S4),TFCW1和TFCW2的总有效读序与细胞过程和信号传导相关,高于TFCW0。
氮代谢过程和编码关键酶的相关功能基因如图5所示。对于NH4+-N氧化,与TFCW0相比,关键酶(包括氨单加氧酶(AMO)和羟胺脱氢酶(HAO)及其编码基因(amoABC和hao)的相对丰度在TFCW1中呈下降趋势,在TFCW2中呈上升趋势。
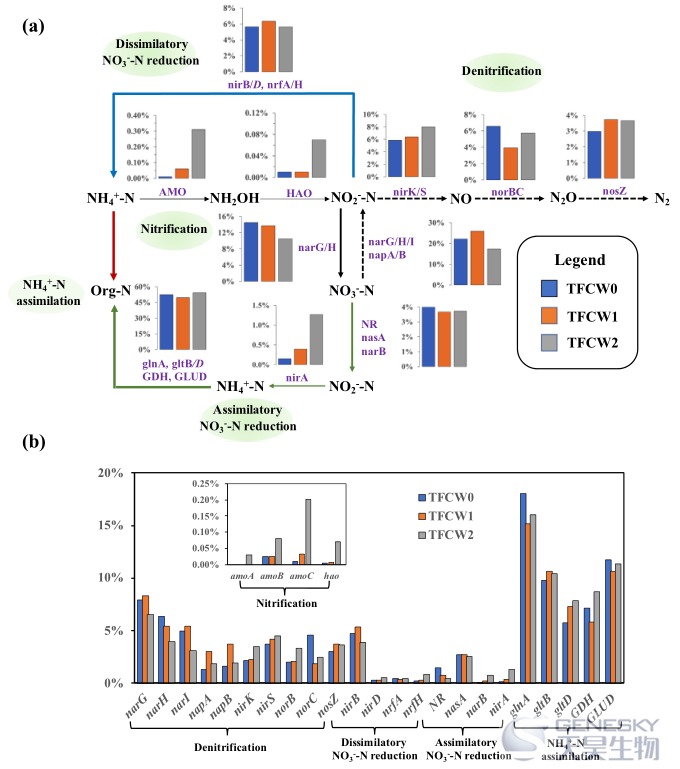
图5、在相同BLAST搜索条件下,参与氮代谢途径的关键酶的相对丰度(a)和氮相关基因的相对丰度(b)。
3.3.5、磷和糖酵解代谢途径
对于磷的转化,聚磷酸激酶(由ppk和ppk2基因编码)和外聚磷酸酯酶(由ppx基因编码)分别主要负责聚磷酸的聚集和降解。可以看出,外聚磷酸酯酶的相对丰度在TFCW0和TFCW1之间没有明显变化,在TFCW2中下降 (图6)。这一现象与TFCW0和TFCW1比TFCW2释放更多的PO43-P相一致,并进一步证明TFCW2中更好的梯度毒性环境有利于添加假单胞菌进行除磷。
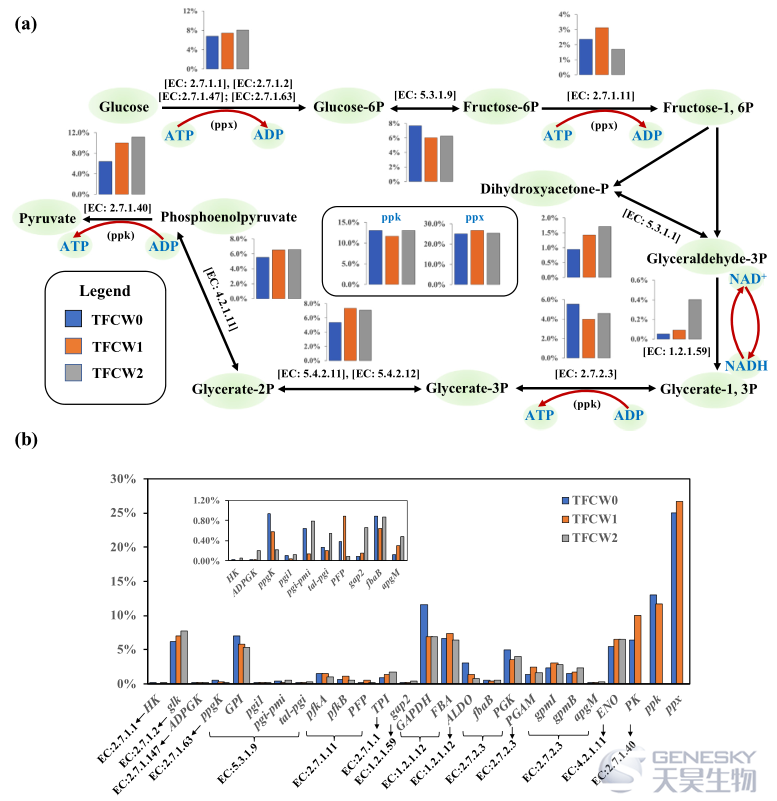
图6、在相同BLAST搜索条件下,糖酵解和磷代谢途径中关键酶的相对丰度(a)和糖酵解和磷相关基因的相对丰度(b)。
目前还不清楚TFCWs的营养物质去除机理。为了更好地应用于分散式生活污水处理,本研究研究了在TFCWs中添加HN-AD菌的强化性能,以及基于宏基因组测序从系统发育结构中识别异养和自养硝化细菌。此外,本研究还提供了氮、磷和糖酵解代谢途径的遗传基础和关系,以阐明潜在的营养物质去除机制。根据我们的发现,提出了一个概念模型来说明对营养物转化的全面见解,以及对TFCWs中添加HN-AD细菌的独特反应(图7)。基于遗传学联系的分类概况表明,TFCWs营养物去除的增强是许多不同代谢反应共同作用的结果。潜在的营养机制是:(1)TFCW中的8-HRT产生异养和自养硝化细菌的共存,这可能通过硝化途径促进铵的氧化;(2)HN-AD菌的加入选择性地影响和刺激了反硝化途径(主要是通过napA和nirS基因)和氮同化途径(主要是通过nirA和gltD基因),有助于缓解CWs较差的脱氮性能,而不是调节氮代谢的每一个过程;(3)糖酵解途径的第一个和最后一个限制性步骤(主要是通过glk和PK基因)可能促进ATP转化中的磷去除;(4)糖酵解途径中产生NADH的关键酶甘油醛-3-磷酸脱氢酶(由gap2基因编码)明显升高,是HN-AD菌营养物质代谢的重要驱动力。
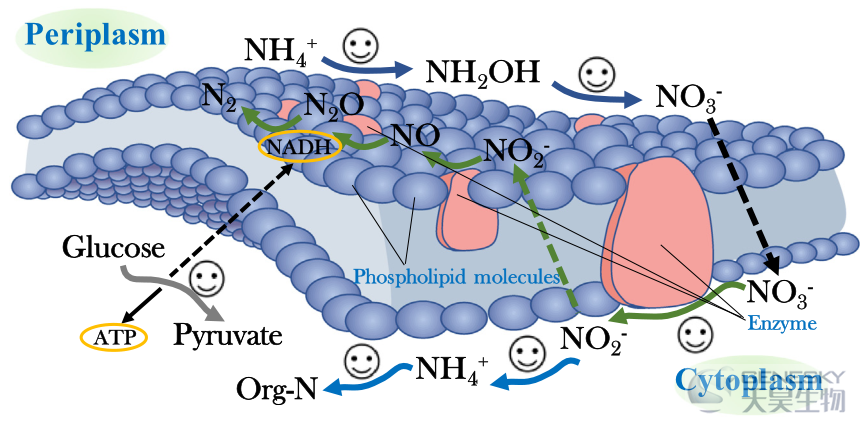
图7、HN-AD过程对TFCW养分转化的多代谢调控的概念模型。
该研究有助于深入了解添加HN-AD菌的分散式生活污水处理系统对氮和磷的强化去除,全面分析微生物分类群、功能基因和代谢联系,以阐明养分转化机制。通过添加HN-AD菌,可缩短TFCWs约10天,实现稳定运行,同时保证了良好的营养物去除性能。在8h-HRT下,总氮和总磷的去除更为强烈,有望减少所需的TFCWs。此外,较好的梯度毒性环境富集了假单胞菌、HN-AD、AOB和NOB,促进了NH4+-N的去除。HN-AD菌的加入选择性地刺激了反硝化和氮同化代谢的反应步骤(主要是napA、nirS、nirA和gltD基因),这可能是斯氏假单胞菌实现HN-AD的主要途径。此外,糖酵解代谢中关键基因glk、PK和gap2的高表达是促进TFCWs中氮和磷去除的潜在驱动力。综上所述,HN-AD菌诱导强化扩大了TFCWs在分散式生活污水处理中的工程应用。
天昊生物微生物测序相关链接:
●喜讯!天昊16S扩增子绝对定量测序项目文章登陆《Bioresource Technology》;
●祝贺!天昊Accu16S细菌绝对定量助力脱氧海水微生物碳氮循环研究登陆一区《Environment International》;
●祝贺!天昊客户微生物扩增子项目成功登陆环境工程和食品科学一区杂志;
●又一篇!天昊Accu16S细菌绝对定量测序项目文章登陆国际顶级环境工程杂志《Bioresource Technology》;
●天昊16S扩增子绝对定量测序项目新文:金针菇β-型糖苷多糖对结肠炎小鼠的抗炎及肠道菌群调节作用;
●又一篇!天昊客户微生物16S扩增子测序再登顶级环境科学杂志《Journal of Hazardous Materials》;
●又一篇!天昊客户微生物16S扩增子测序再登顶级环境科学杂志《Journal of Hazardous Materials》;
●医学、农学新应用,天昊Accu16S细菌绝对定量测序技术在骨质疏松和农业复垦领域收获新文;
●向“真”而生!天昊生物AccuITS真菌绝对定量测序服务重磅上线;
●喜讯!天昊生物16S扩增子绝对定量测序项目文章再次登陆《Science of the Total Environment》;
●祝贺!天昊生物16S扩增子绝对定量测序技术助力客户登陆Science of the Total Environment;
●又一篇!天昊生物微生物16S扩增子绝对定量测序技术再发好文;
●天昊微生物项目文章:水生高等植物凋落物分解过程中细菌与真菌之间的相互作用;
●【昊文章】天昊客户细菌+真菌扩增子测序文章见刊《Frontiers in Microbiology》;
咨询沟通请联系
18964693703(微信同号)

创新基因科技,成就科学梦想

 咨询热线:400-065-6886
咨询热线:400-065-6886

 咨询热线:400-065-6886
咨询热线:400-065-6886















