技术简介
环状RNA(circRNA)是一类区别于传统的线性 RNA分子,不具有5’端帽子和3’端 poly(A)尾巴,以共价键形式头尾相连形成圆环结构,不受RNA外切酶影响,表达更稳定,不易降解。circRNA广泛存在于动植物中,具有物种保守性和组织特异性。circRNA功能众多,可充当miRNA海绵竞争结合miRNA,发挥ceRNA的功能调节基因表达。通过二代测序和生物信息分析鉴定出来的circRNA是否真实存在,需要通过实验进一步验证。
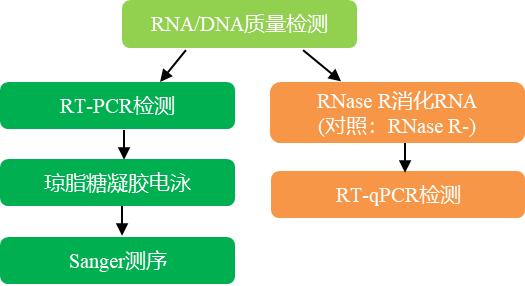
针对circRNA和其来源线性RNA(mRNA)分别设计特异性引物Divergent Primer(发散引物)和Convergent Primer(收敛引物),以cDNA和gDNA为模板进行PCR扩增,根据目的条带的有无判断序列是否为circRNA,进一步通过Sanger测序确认Junction reads。RNase R消化Total RNA,以RNase R(+)和RNase R(-)为模板进行qPCR扩增分别检测circRNA和线性RNA的丰度,验证circRNA耐受RNase R消化的特性。
技术参数
1.提供胶图、Sanger测序原始峰图文件、qPCR原始数据文件
2.每个circRNA设计2对引物(Divergent Primer和Convergent Primer)
3.每个circRNA进行4个PCR验证与琼脂糖电泳,1个反应的Sanger测序
4.RNaseR耐受实验,每个circRNA提供12个qPCR检测反应,2对引物× 2(RNase R处理前后)× 3重复
数据展示
图1 RT-PCR琼脂糖凝胶电泳图
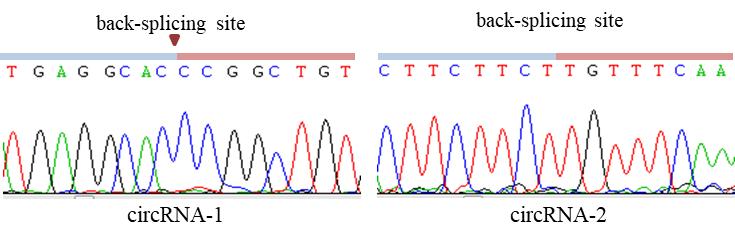
图2 Sanger测序图
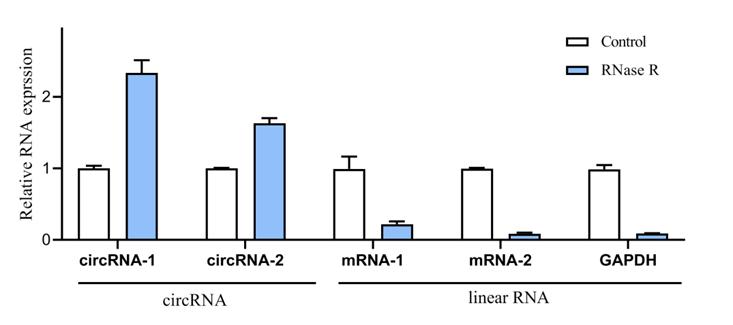
图3 RNase R消化前后circRNA和linear RNA相对表达量
技术路线
样品要求与建议
RNA
1.样品类型:完整无基因组DNA污染的Total RNA
2.样品需求量:Qubit检测,要求浓度≥100 ng/μL;总量≥3 μg
3.样品完整度:琼脂糖凝胶电泳图18S、28S条带清晰,无挂孔
4.每个离心管用parafilm膜密封,干冰运输(-70℃),保证运输途中干冰不会完全融化
5.如需进行核酸抽提,样本需符合天昊生物所要求的样本类型、保存及送样条件,详见《天昊生物组织送样要求与建议》;
DNA
1.样品需求量:Qubit检测,要求浓度Qubit≥10 ng/ul;总量≥100 ng
2.样本完整度:琼脂糖凝胶电泳图基因组DNA条带清晰,无明显降解
3.如需进行核酸抽提,样本需符合天昊生物所要求的样本类型、保存及送样条件,详见《天昊生物组织送样要求与建议》;
分析与结果
1.Sanger测序峰图,展示circRNA junction位点附近的序列
2.琼脂糖凝胶电泳图,展示待检测circRNA分别以对应的cDNA和gDNA为模板,Divergent Primer和Convergent Primer为引物的PCR结果
3.RNase R消化前后相对表达量柱状图,展示待检测circRNA和线性mRNA参照(默认为GAPDH和待检测circRNA对应的mRNA)在RNase R线性消化前、后,特异性检测引物的相对表达量,以RNase R消化前的表达量为100%进行校正。特异性引物对于circRNA使用Divergent Primer,对于线性mRNA使用Convergent Primer
相关文献
Panda, A. C. & Gorospe, M. Detection and Analysis of Circular RNAs by RT-PCR. Bio Protoc 8, doi:10.21769/BioProtoc.2775 (2018).
常见问题
问1:circRNA鉴定时RNase R消化是否必须做?为什么需要DNA?
答1: circRNA鉴定时推荐做RNase R消化。 circRNA鉴定首先以cDNA为模板,使用Divergent Primer进行RT-PCR扩增,得到预期条带后对PCR产物进行Sanger测序,剪接位点处的序列正确则证明circRNA真实存在;增加gDNA的对照实验,使用Divergent Primer和Convergent Primer检测cDNA和gDNA模板,Divergent Primer在cDNA可以正常扩增,在gDNA无法扩增,而Convergent Primer在cDNA和gDNA中均能扩增,所以根据目的条带的有无进一步鉴定circRNA;接着可以增加RNase R的抵抗实验,设置RNase R组和Control组,RNase R组中对Total RNA进行RNase R消化,Control组不进行RNase R消化,使用Divergent Primer和Convergent Primer检测RNase R组和Control组的cDNA模板,在RNase R组中线性RNA的扩增条带变淡甚至扩不出来,而circRNA的扩增条带变化不明显,验证了circRNA耐受RNase R消化的特性。
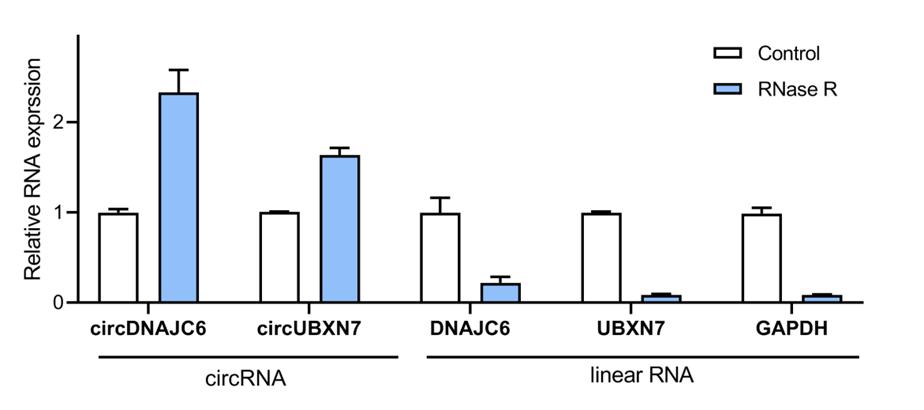
问2:为什么有时RNase R消化后circRNA的相对表达量升高了很多?
答2:明确一点,这是circRNA耐受RNase R消化的验证实验。Total RNA经RNase R消化后circRNA的相对比例会上升,模板复杂度降低,可能会导致circRNA的逆转录和PCR扩增效率提高,进而出现RNase R消化后circRNA的表达量相对消化前升高的情况(见下图)。
问3:circRNA qPCR相对表达量检测计算时有没有内参或者外参?
答3:通过与线性内参RNA表达量进行比较,实验样本不经过RNase R消化,用ΔCt法对目的circRNA基因进行相对定量,ΔCt=Ct(目的基因) - Ct(内参基因),相对表达量=2^(-ΔCt)。目前没有添加外参进行表达量计算的方案。

 咨询热线:400-065-6886
咨询热线:400-065-6886

 咨询热线:400-065-6886
咨询热线:400-065-6886