
 咨询热线:400-065-6886
咨询热线:400-065-6886

 咨询热线:400-065-6886
咨询热线:400-065-6886
代谢组是指某一生物或细胞在一特定生理时期内所有的低分子量代谢产物总和,代谢组学则是对某一生物或细胞在一特定生理时期内所有低分子量代谢产物同时进行定性定量分析,代谢组学则可以告诉我们实际发生的事件,因此代谢组学更能反映个体的病理生理状态。代谢组包括非靶向代谢组和靶向代谢组,非靶向代谢组可以无偏向性地对样本中所有代谢物进行检测。检测平台主要包括液相色谱质谱联用(LC-MS)、气相色谱质谱联用(GC-MS)。非靶向代谢组研究需要采用高分辨率质谱,这样才可以检测到尽可能多的代谢物。
溃疡性结肠炎(UC)和克罗恩病(CD)是炎症性肠病(IBD)的两种形式,具有相似的触发因素,两者都被归为慢性炎症反应,由肠功能不全引起。两者的区别在于,克罗恩病发生在胃肠道的任何部位,尤其是回肠末端,而UC主要发生在结肠。UC是一种与宿主遗传、免疫功能紊乱和环境变化有关的间歇性炎症反应。葡聚糖硫酸钠(DSS)能破坏肠黏膜屏障的完整性,激活巨噬细胞分泌炎症因子,最终诱发UC。DSS诱导的UC小鼠是一种典型的模拟人类肠道炎症性疾病症状的模型,包括黏膜蛋白损伤、肠溃疡、腹泻、结肠缩短和便血,用于研究不同生物活性成分对肠道健康的影响。
生物大分子存在于中药、植物和食用菌中,具有肠道微生物调节等多种生理功能。生物大分子物质与肠道微生物的相互作用,直接导致肠道微生物群落结构的改变,进而影响相关功能酶和蛋白质的表达,这种生理变化与代谢性疾病和炎症性疾病密切相关。报道,代谢性疾病的发生或发展与肠道微生物及其代谢产物的生理活动密切相关,如肥胖和2型糖尿病。更重要的是,肠道微生物与肠道炎症和癌症有关,如UC和结肠癌。一项研究表明,枸杞花色苷可通过调节肠道相关蛋白的表达,改变肠道菌群结构,改善DSS诱导的UC小鼠症状。黄芪多糖能改善DSS诱导的UC小鼠结肠组织学评分,增加体重和结肠长度,降低NF-κВ DNA磷酸化活性,是治疗IBD的天然途径。石斛多糖具有减轻溃疡性结肠炎(UC)小鼠结肠组织病理损伤和重建炎性细胞因子平衡的作用。
金针菇是我国传统食用菌,具有栽培历史悠久、工业化生产率高等特点,在我国消费广泛。以往的研究为金针菇多糖具有调节肠道微生物群的能力提供了佐证,同时,这种不含淀粉的生物活性多糖,通过调节促炎细胞因子的表达,也显示出一定的免疫调节活性。本实验室的前期研究表明,金针菇多糖(FVP)能调节肠道菌群,增加血清免疫球蛋白和细胞因子,提示FVP在肠道内的发酵过程可能代表了一种免疫调节能力,总之,FVP代表了调节肠道微生物群和改变免疫反应的能力。但从以往的研究来看,只是证明了FVP对肠道菌群和宿主免疫应答的调节作用,没有证据表明健康小鼠肠道微生物发生了有益的变化。由于免疫应答与炎症反应的相关性,有必要研究FVP对肠道炎症的影响。然而,关于FVP对肠道炎症的影响的信息很少。因此,阐明FVP与溃疡性结肠炎(UC)肠道微生物介导的抗炎作用的关系至关重要。
作为填补我们知识空白的一步,本研究评估了FVP对UC小鼠的抗炎作用,结肠组织学改变,促炎细胞因子含量,相对mRNA表达,与炎症相关的特定肠道微生物种类都被考虑在内。我们假设这种具有β-型糖苷键和呋喃糖环的非淀粉多糖可能通过调节肠道微生物群来改变宿主的代谢功能,从而达到抗炎的目的。
4周龄C57BL/6J雄性小鼠(SPF级,20±2g,n=48)购自南京医科大学,实验程序在南京农业大学动物中心进行。每只小鼠适应新的25±2°C的生活环境和12/12h的光暗循环7天。所有小鼠均饲喂半纯和日粮,饲料成分见表S1。7天后,将小鼠随机分为4组(SD、SD-FVP、DSS、DSS-FVP):SD组和SD-FVP组在实验期间给予纯水。在DSS组和DSS-FVP组,在第7-11、18-22、29-33、41-44天用1.5%葡聚糖硫酸钠(DSS)盐代替纯水。SD-FVP和DSS-FVP组在实验期间每天灌胃给予FVP(400mg/kg体重)。在SD、DSS组,小鼠灌胃给予蒸馏水作为对照(图1A)。每天灌胃给药后,每只小鼠称重,以调整第二天灌胃喂养(0.1mL/10g体重)的给药量。所有的老鼠都是在免费获得食物和水的情况下饲养的,每周记录饲料消耗量。疾病活动指数(DAI)评分由体重减轻程度、大便稠度和便血情况决定。实验结束时,所有小鼠在二氧化碳吸收麻醉后颈椎脱位处死,测量结肠长度,取血清及各脏器(脑、肝、肾、盲肠、结肠),于-80℃保存至检测。所有动物程序均按照NIH(2011年)《实验室动物护理和使用指南》中的指南进行,所有处理均得到南京农业大学实验动物中心动物伦理委员会批准,批准文号:SYXK (SU) 2017-0007。
切除的结肠立即用4%中性福尔马林固定。组织病理学分析:取标本用乙醇脱水,石蜡包埋切片,二甲苯脱蜡10min,苏木精伊红染色观察。所有组织切片均采用盲法评估。切片根据炎症浸润程度(0-5)、隐窝损伤程度(0-4)、溃疡程度(0-3)和水肿有无(0或1)进行评分。
采用ELISA试剂盒测定血清中肿瘤坏死因子-α(TNF-α)、干扰素-γ(IFN-γ)、白细胞介素1β(IL-1β)、白细胞介素6(IL-6)、单核细胞趋化蛋白-1(MCP-1)和巨噬细胞炎性蛋白-1α(MIP-1α)的含量。
采用气相色谱分析(GC)测定小鼠盲肠内容物和粪便中SCFAs的浓度,包括乙酸、丙酸、异丁酸、丁酸、异戊酸、戊酸。简而言之,采集的样品用H2 SO 4和二乙基进行预处理。使用Agilent 7890A气相色谱仪进行气相色谱分析。具体而言,在0.025-0.8mol/L范围内绘制乙酸的标准曲线,在0.00125-0.4mol/L范围内添加4-甲基戊酸作为内标,绘制丙酸、异丁酸、正丁酸、戊酸和正戊酸的标准曲线。每个样品分为三份。
用Trizol提取小鼠结肠总RNA。使用SMA2000超微量紫外分光光度计进行定量。逆转录成cDNA,以甘油醛-3-磷酸脱氢酶(GAPDH)为管家基因,用2-ΔΔCt计算基因相对表达水平。
使用E.Z.N.A.? Bacterial DNA Kit提取小鼠粪便细菌总DNA,DNA样本送至上海天昊生物科技有限公司进行16S扩增子绝对定量测序(V3-V4)。
体重、摄食量、耗水量、疾病活动指数评分、结肠长度和脏器相对重量的变化如图1所示。SD组和SD-FVP组的体重(图1B)呈上升趋势,而DSS组和DSS-FVP组在最后两个周期(29-33天、41-44天)后体重呈下降趋势,且DSS组较其它组有显著下降趋势(P<0.05)。同时,疾病活动指数(DAI)(图1E)显示,在第一个周期中,DSS饮用水处理前(0-6天),小鼠的粪便出现形成,没有腹泻和便血;在DSS饮用水处理后(7-11天),DSS组的粪便开始软化,尽管DSS-FVP组的DAI评分高于对照组SD,但低于DSS组。在停止DSS处理后的恢复期(12-17天),DSS组和DSS-FVP组小鼠粪便恢复到健康水平。第22天,DSS组小鼠再次给予DSS处理后,出现轻度便血。第33天,随着摄食量的减少,DSS组小鼠出现体重减轻,并伴有严重腹泻和便血症状。第44天,DSS组小鼠出现腹泻、便血和摄食量减少,但经FVP给药后,DSS-FVP组UC症状明显减轻,与DSS组比较差异有显著性(P<0.05)。对DSS组和DSS-FVP组小鼠在DSS处理期间的耗水量进行计数,结果显示无显著性差异(P﹥0.05)(图1D)。四组小鼠结肠长度如图1 F所示,DSS组结肠长度较SD和SD-FVP组短(P<0.05),但经FVP给药后,UC引起的结肠缩短症状有所减轻(与SD和SD-FVP组相比,P<0.05)。

图1(A)实验程序;(B)体重;(C)食物消耗量;(D)耗水量;(E)DAI评分;(F)结肠长度;(F)内脏相对重量。
小鼠结肠组织的组织学变化如图2所示。SD组和SD-FVP组生理形态正常,无炎症反应和上皮细胞损伤。DSS处理后的小鼠结肠杯状细胞和浅表上皮细胞均消失,单核白细胞浸润。经FVP治疗后,DSS-FVP组病理损伤明显减轻,大部分杯状细胞保持正常生理形态,炎症反应明显减轻,具体反映在组织学评分中(图2 I)。
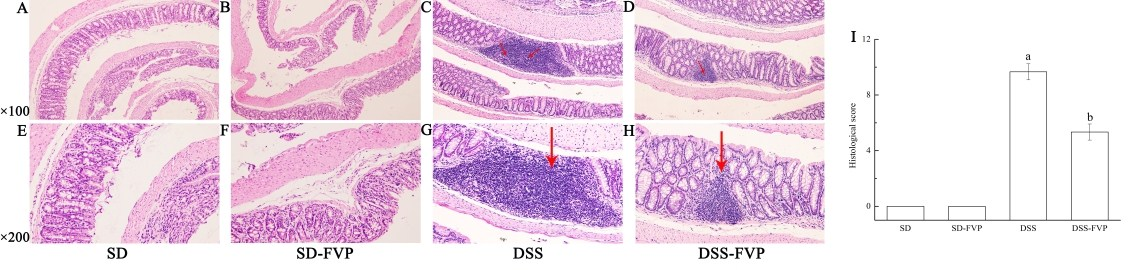
图2a-H:镜下可见经苏木精和伊红染色的结肠组织切片;I:组织学评分。
结肠组织和血清中促炎细胞因子(包括TNF-α、IFN-γ、IL-1β、IL-6、MCP-1和MIP-1α)如图3所示。与SD组相比,DSS组大鼠结肠组织中促炎细胞因子显著升高(P<0.05),FVP治疗后,DSS-FVP组TNF-α、IL-6、MCP-1和MIP-1α水平低于DSS组(P<0.05),与SD、SD-FVP组相似。DSS组和DSS-FVP组IFN-γ和IL-1β表达水平无显著性差异。除细胞因子TNF-α外,血清中也有类似的变化趋势。提示FVP可降低UC致炎性细胞因子的升高。
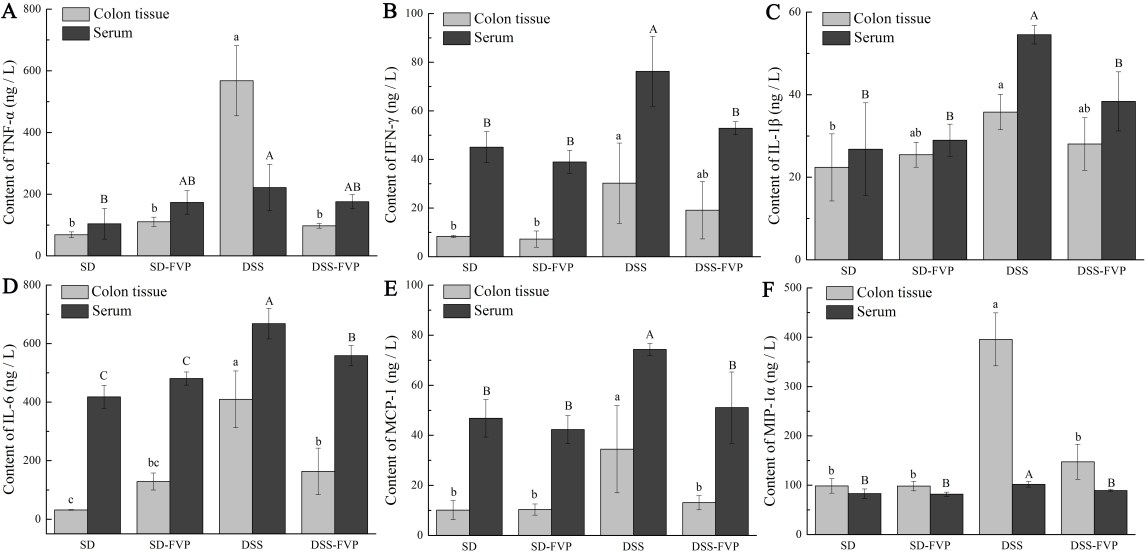
图3 FVP对免疫细胞因子浓度的影响。(A) TNF-α;(B) IFN-γ;(C) IL-1β; (D) IL-6; (E) MCP-1; (F) MIP-1α。
FVP对结肠促炎细胞因子和紧密连接蛋白mRNA表达水平的影响如图4所示。与DSS组相比,DSS-FVP可抑制TNF-α、IFN-γ、IL-1β、IL-6、MCP-1、MIP-1α和诱导型一氧化氮合酶(iNOS)的相对mRNA表达。此外,FVP处理后,caludin-1、ZO-1的mRNA相对表达增加(P<0.05)。总的来说,FVP可以调节促炎细胞因子和紧密连接蛋白的mRNA表达,减少UC引起的mRNA表达的变化。
盲肠内容物中乙酸,丙酸,异丁酸,正丁酸,异戊酸,正戊酸和总酸的浓度如图5A所示。DSS组的总酸浓度较低(P<0.05)。经FVP处理后,DSS-FVP组总酸、乙酸、丙酸和正丁酸浓度均升高(P<0.05)。在粪便样本中也有类似的趋势(图5B)。说明FVP能增加盲肠内容物和粪便中SCFA的含量。
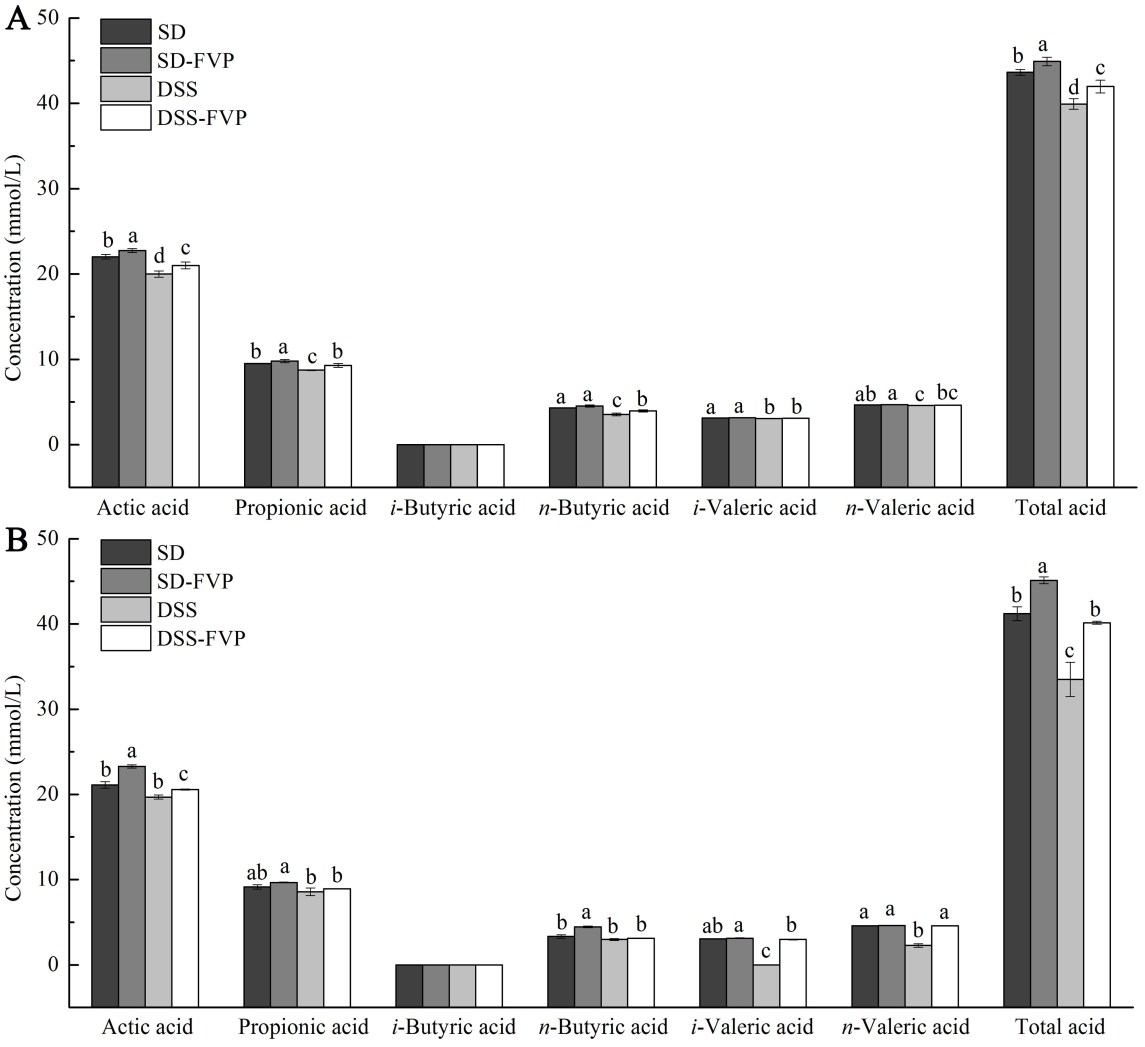
图5 FVP对SCFA产生的影响(A)盲肠内容物;(B)粪便。
小鼠肠道微生物多样性分析见图6。这4组之间的香农和辛普森指数如图6A和B所示,与SD组相比,DSS组的Shannon指数和Simpson指数均较低(P<0.05),说明UC引起的微生物群落多样性较低,但经FVP处理后,DSS-FVP组微生物群落多样性有所提高,正如我们预期的那样,FVP可以促进UC小鼠体内微生物群落的多样性。PCA和PCoA如图6C和D所示,DSS组在X轴上与SD组和SD-FVP组完全分离(PCA为24.786%,PCoA为27.55%),经FVP处理后,DSS-FVP组与SD组在X轴(PCA和PCoA)的距离均较DSS组近,结果表明,经FVP处理后,DSS引起的肠道菌群变化得到缓解。样本聚类树如图6E所示,显示DSS和DSS-FVP组、SD和SD-FVP组的肠道菌群组成相似,而DSS-FVP组比DSS组更接近SD-FVP和SD组。维恩图如图6F所示,四组小鼠共有408种肠道微生物,经DSS和FVP处理后,DSS组有10种独特的肠道微生物,DSS-FVP组有9种独特的肠道微生物,SD-FVP组有35种独特的肠道微生物,说明各组之间的相似性和差异性。
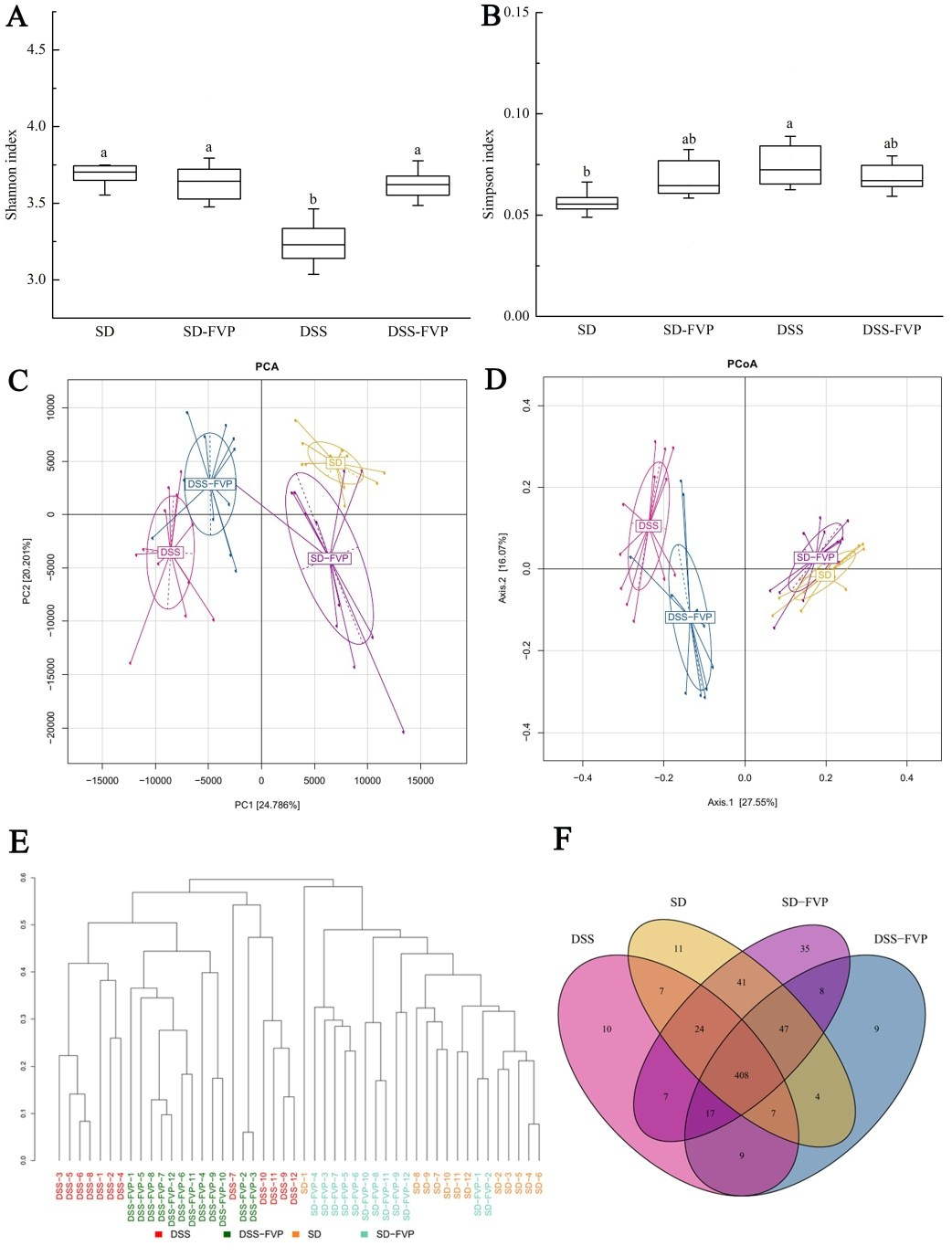
图6基于16S rRNA基因序列的小鼠粪便微生物群多样性。(A) 香农指数;(B)辛普森指数;(C)主成分分析;(D)主坐标分析;(E)样本聚类树;(F)维恩图。
门水平小鼠肠道微生物的变化如图7所示,每个样品主要由Bacteroidetes、Firmicutes、Verrucomicrobia、Proteobacteria、Actinobacteria组成。图7 A1显示了粪便微生物群落的绝对丰度,显示了每克粪便样品中肠道微生物的细胞总数和每个门的肠道微生物细胞数。图7 A2显示了每个门的相对丰度,代表了每个门中肠道微生物的比例。DSS处理后Bacteroidetes数量减少(P<0.05),FVP灌胃后Bacteroidetes数量增加到接近SD组和SD-FVP组的水平(P<0.05)(图7B)。相反,Firmicutes在DSS处理后显著增加,而在FVP灌胃处理后减少(图7c)。Verrucomicrobia, Proteobacteria、Actinobacteria的丰度在图7A1和A2中是浮动的。此外,图7E所示的Firmicutes / Bacteroidetes比率代表了不同处理组之间的差异。
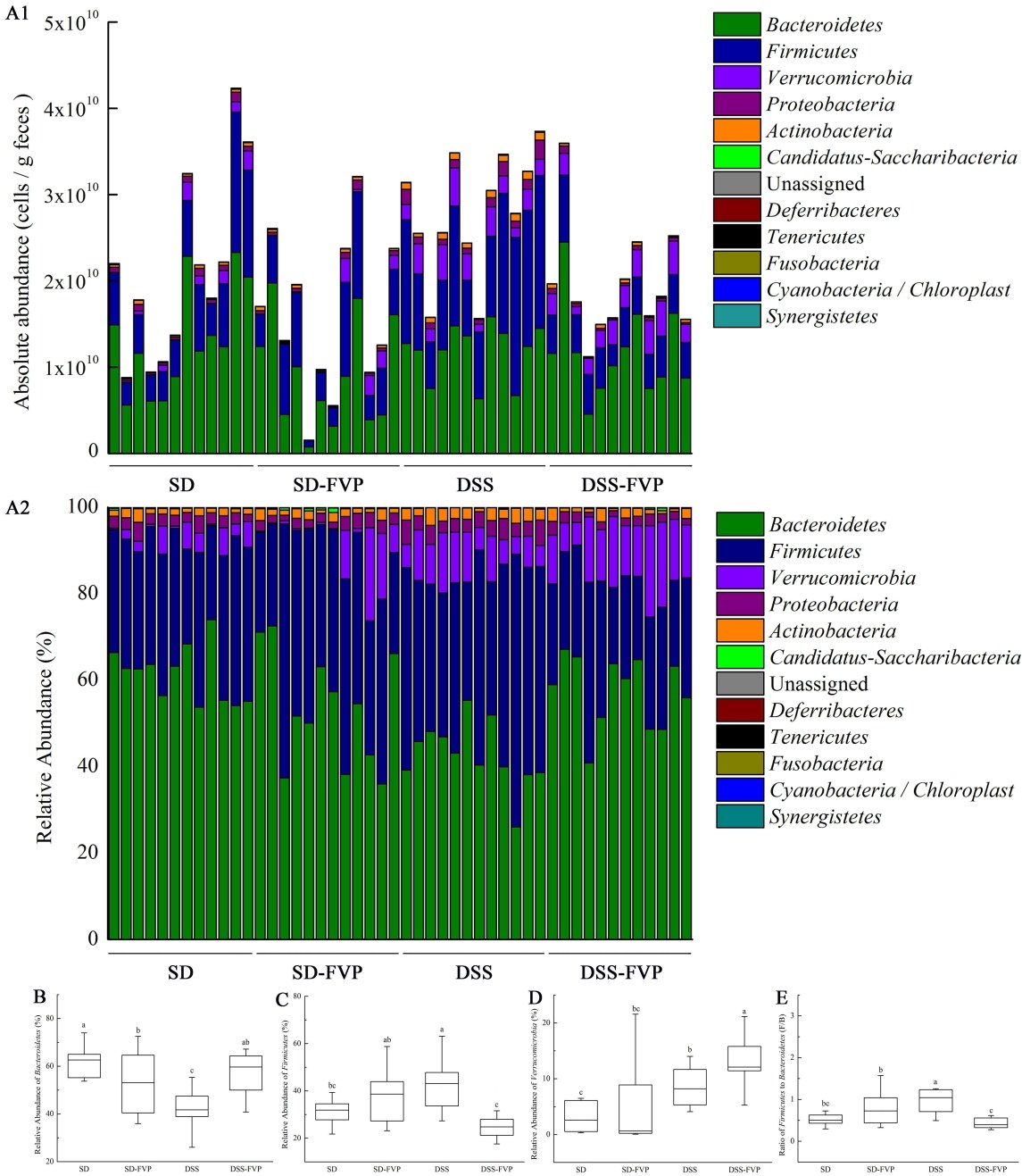
图7门水平小鼠肠道微生物组成。(A1)48个粪便微生物组中主要门的绝对丰度;(A2)48个粪便微生物组中主要门的相对丰度;(B)每个分组微生物组中Bacteroidetes的相对丰度;(C)每个分组微生物组中Bacteroidetes的相对丰度;(D) 每个微生物组中Verrucomicrobia的相对丰度;(E)Firmicutes/Bacteroidetes的比率。
科水平的相对丰度存在差异,包括Porphyromonadaceae, Erysipelotrichaceae, Verrucomicrobiaceae, Lachnospiraceae, Lactobacillaceae, Bacteroidaceae, Ruminococcaceae, Rikenellaceae(图8)。Porphyromonadaceae的相对丰度在DSS组呈下降趋势,但经FVP处理后增加。Lachnospiraceae的趋势与之相反。四组间乳酸菌相对丰度无显著性差异,但从绝对定量测序结果来看,DSS组Lactobacillus的绝对丰度实际上有所下降。

图8 科水平鼠肠道微生物组成。(A1)48个粪便微生物组中主要科的绝对丰度;(A2)48个粪便微生物组中主要科的相对丰度;(B)各分组微生物组中Porphyromonadaceae的相对丰度;(C)各分组微生物组中Erysipelotrichaceae的相对丰度;(D)各分组微生物组中Verrucomicrobiaceae的相对丰度;(E)各分组微生物组中Lachnospiraceae的相对丰度;(F)各分组微生物组中Lactobacillaceae的相对丰度;(G)各分组微生物组中Bacteroidaceae的相对丰度;(H)各分组微生物组中Ruminococcaceae的相对丰度;(I)各分组微生物组中Rikenellaceae的相对丰度。
图9为UC相关症状、相关基因表达与肠道微生物相关性分析的进一步研究。共选取11种菌种进行相关分析,测序结果表明,这11种菌种的相对丰度变化趋势相同:即DSS处理与SD组相比,相对丰度发生变化(增加或减少),而DSS-FVP组经FVP处理后得到恢复,指的是差异的减少或消失,说明经FVP灌胃后,UC引起的肠道菌群失调得到缓解或消除。这11种肠道微生物与肠道炎症症状及相关基因表达呈显著或极显著相关。
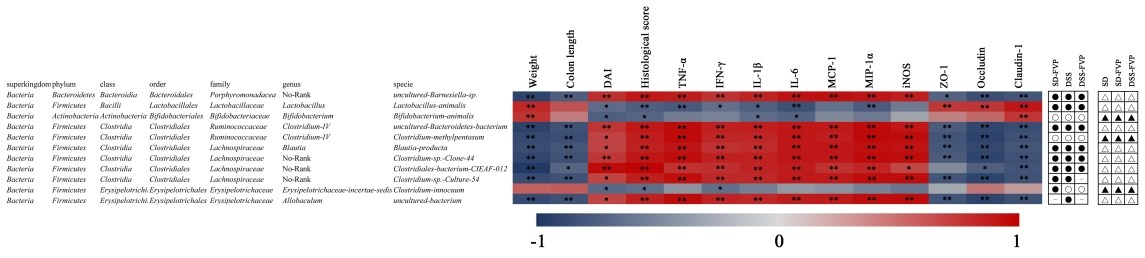
图9经FVP干预逆转的11个物种与IBD参数的Spearman相关分析。热图显示相关系数的值。圆圈(○)和(●)表示SD-FVP或DSS或DSS-FVP组与SD组相比物种相对丰度减少和增加;三角形(△)和(▲)分别表示SD或SD-FVP或DSS-FVP组与DSS组相比中物种相对丰度相对减少和增加。*和**表示相关性显著(分别为P<0.05和P<0.01)。
根据肠道菌群的变化,PICRUSt预测了DSS和FVP引起的功能变化,如图10所示。DSS组与SD组比较,15个(9个富集,6个减少)功能模块发生改变(P<0.05)。经FVP处理后,DSS-FVP组8个功能模块富集,主要引起一些代谢途径的改变,如次生代谢物的生物合成、转运和分解代谢;细胞内的转运、分泌和囊泡转运;辅酶和脂质的转运和代谢。与DSS组相比,DSS-FVP组细胞骨架、细胞壁、膜和包膜生物发生相关的功能模块也较DSS组得到富集(P<0.05)。
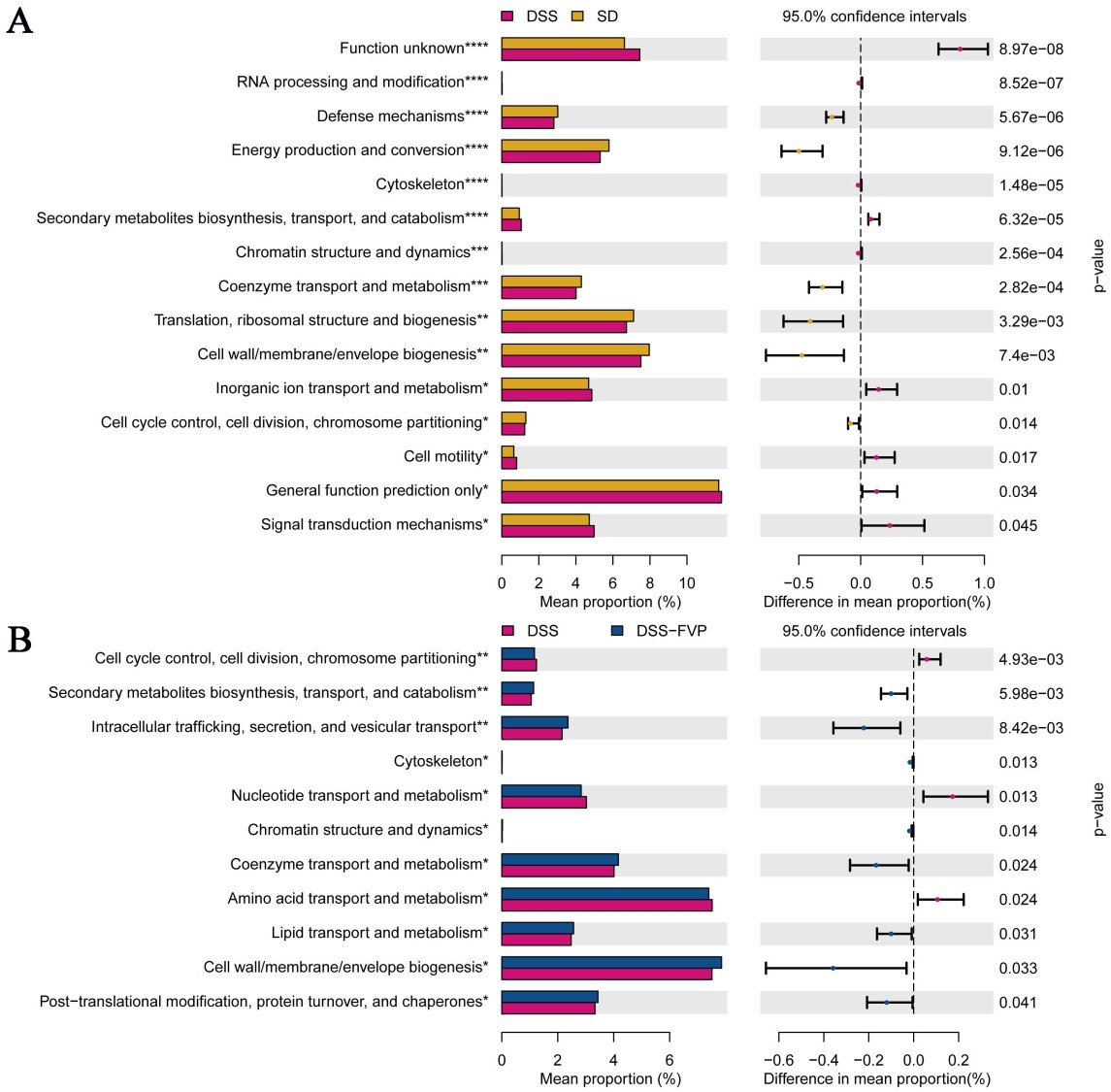
图10 PICRUSt预测被DSS和FVP改变的微生物群落功能变化。(A) DSS和SD组;(B)DSS-FVP和DSS组。*、**、***、***和****表示关联显著。