由宁夏医科大学药学院张万年教授、曲卓副教授研究团队和海军军医大学等单位合作,研究成果在国际期刊《Chemico-Biological Interactions》(IF=5.192)上发表。研究者使用微生物扩增子测序和代谢组学等技术,检测了香烟烟雾混合致癌物对小鼠肠道微生物群和代谢稳态的影响。
在本项研究中,天昊生物有幸承担了微生物16S扩增子测序和代谢组学检测,以及数据的联合分析工作,在恭喜客户取得好成绩的同时,让我们简单看下这篇文章。

接触香烟烟雾混合致癌物会扰乱肠道微生物群并影响小鼠体内的代谢稳态
患肺癌的风险增加与接触香烟烟雾致癌物和肠道微生物群的改变有关。然而,对于暴露于NNK和BaP(香烟烟雾致癌物的两种重要成分)对肺癌肠道微生物群的影响了解有限。本研究描述了暴露于NNK和BaP的混合物对小鼠肺癌、粪便代谢物组成和肠道微生物群的影响。给A/J小鼠施加NNK和BaP,并分别使用16S rRNA基因测序和代谢组学表征肠道微生物群和粪便代谢谱的变化。光学显微镜和组织病理学评估结果表明,NNK和BaP的混合物暴露触发了肺癌的发生。肠道微生物群的16S rRNA测序表明,暴露于NNK加BaP可以改变粪便细菌组成。放线菌、双歧杆菌和肠杆菌水平的升高以及理研菌、内脏异味杆菌和Acetatifactor菌水平的降低与NNK和BaP引发的肺癌有关。此外,代谢组学图谱揭示了相关的代谢调节,包括嘌呤代谢、苯丙氨酸代谢、初级胆汁酸生物合成、类固醇激素生物合成、不饱和脂肪酸生物合成、亚油酸代谢等。总之,该结果为利用肠道微生物作为生物标志物来评估肺癌的进展提供了一定的指导,并为未来控制该疾病的发展带来了干预靶点。
肺癌最常见的癌症之一,越来越多的证据表明,吸烟是所有组织类型肺癌的主要风险。因此,避免接触香烟烟雾是预防肺癌的最好方法。
大量证据支持多环芳烃和亚硝胺4-(甲基亚硝胺基)-1-(3-吡啶基)-1-丁酮(NNK)是肺癌的主要病因。多环芳烃是研究最彻底的致癌物之一。苯并[a]芘(BaP)是一种五环多环芳香烃,存在于多环芳烃混合物中,是在香烟烟雾中检测到的第一种致癌物。
肠道微生物群被认为是人类的“第二基因组”,它可以影响宿主的新陈代谢、内分泌和免疫系统,以及中枢神经系统。最近,肠道微生物群越来越被认为是与包括肺癌在内的一些恶性肿瘤相关的重要因素。研究表明,肠道微生物群和肺之间存在重要的串扰,这就是所谓的肠道-肺轴。肠道微生物群可以通过肠-肺轴改变肺的免疫状态,当肺部发生炎症时,肺-肠轴可以双向诱导血液和肠道微生物群的变化。
在本研究中,研究者通过口服NNK加BaP成功地利用A/J小鼠建立了肺腺癌动物模型。A/J小鼠携带肺腺癌易感性1 (Pas1)基因,与Kras癌基因紧密相连,使小鼠对肺肿瘤的发生高度敏感。然而,没有研究揭示NNK加BaP诱导的肺癌对肠道微生物生态失调的影响。在此,研究者进一步检测了肺癌小鼠的肠道微生态。
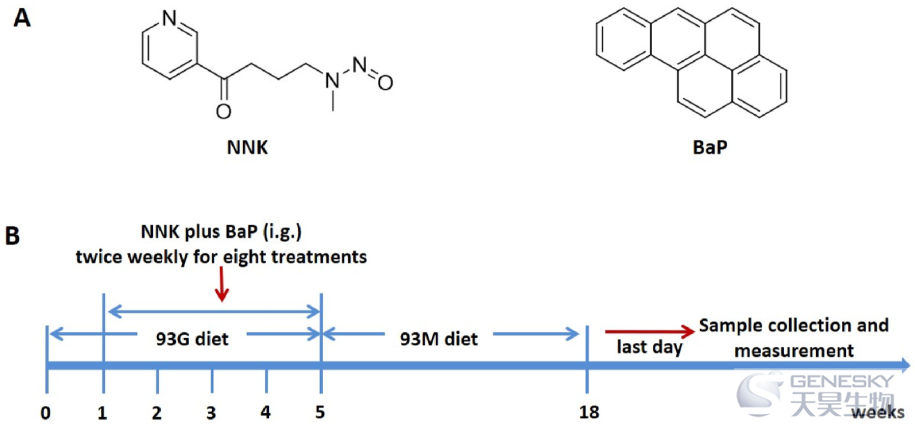
图1、(A)NNK和BaP的化学结构。(B)NNK加Bap诱导小鼠肺癌的示意图。
实验设计如图1B所示,对5-6周龄雌性A/J小鼠喂食AIN-93G食物。驯化1周后,将所有小鼠随机分为2组(每组15只):对照组(小鼠口服等体积羧甲基纤维素钠水溶液)和NNK-BaP组(小鼠口服NNK 2μmol+BaP 2μmol混合物,每周2次,共8次)。然后,在实验期间,小鼠被切换到AIN-93 M食物。处理结束时,处死小鼠并收获肺组织,对肿瘤进行计数并采集肺部图像。每组50%小鼠的肺保存在4%多聚甲醛中,其他的保存在超低温冰箱中。
对获得的不同组别小鼠肺部组织进行病理检测、肠道微生物群16S rRNA测序(粪便样本、V3-V4)和非靶向代谢组学分析(粪便样本)。
本研究建立了NNK加BaP诱导的小鼠肺癌模型(图2A)。NNK-BaP组小鼠均出现肺部肿瘤,数量为11.3±2.5(图2B)。相比之下,对照组小鼠没有肿瘤位点。用H&E染色法对NNK加BaP小鼠的肺组织进行了组织学评价(图2C)。NNK-BaP组可见增生。与对照组小鼠相比,实体腺瘤排列成具有不同分化程度的簇,在NNK-BaP处理的小鼠中,小鼠肺中正常的肺泡结构丧失。这些发现表明,NNK加BaP可以触发小鼠肺部肿瘤的发展、多样性和肿瘤负荷。

图2、烟草致癌物NNK加BaP诱导的肺癌小鼠模型。(A)小鼠肺部结节的解剖照片。(B)在实验终点分析肿瘤数量。(C)通过肺组织切片的H&E染色评估NNK加BaP诱导的组织病理学变化。
为探讨肺癌小鼠肠道微生物群落特征,将NNK-BaP诱导肺癌组和对照组不同水平的微生物相对分类丰度进行了比较。结果表明,NNK-BaP处理后,微生物区系组成发生了明显变化(图3)。在门水平上,肠道微生物群主要由拟杆菌门、厚壁菌门、变形菌门等组成。Metastats分析结果显示,NNK-BaP组放线菌的相对丰度水平显著升高。在属水平上,NNK-BaP处理后,理研菌、内脏异味杆菌和Acetatifactor菌水平显著降低,而双歧杆菌和肠杆菌的显著升高。
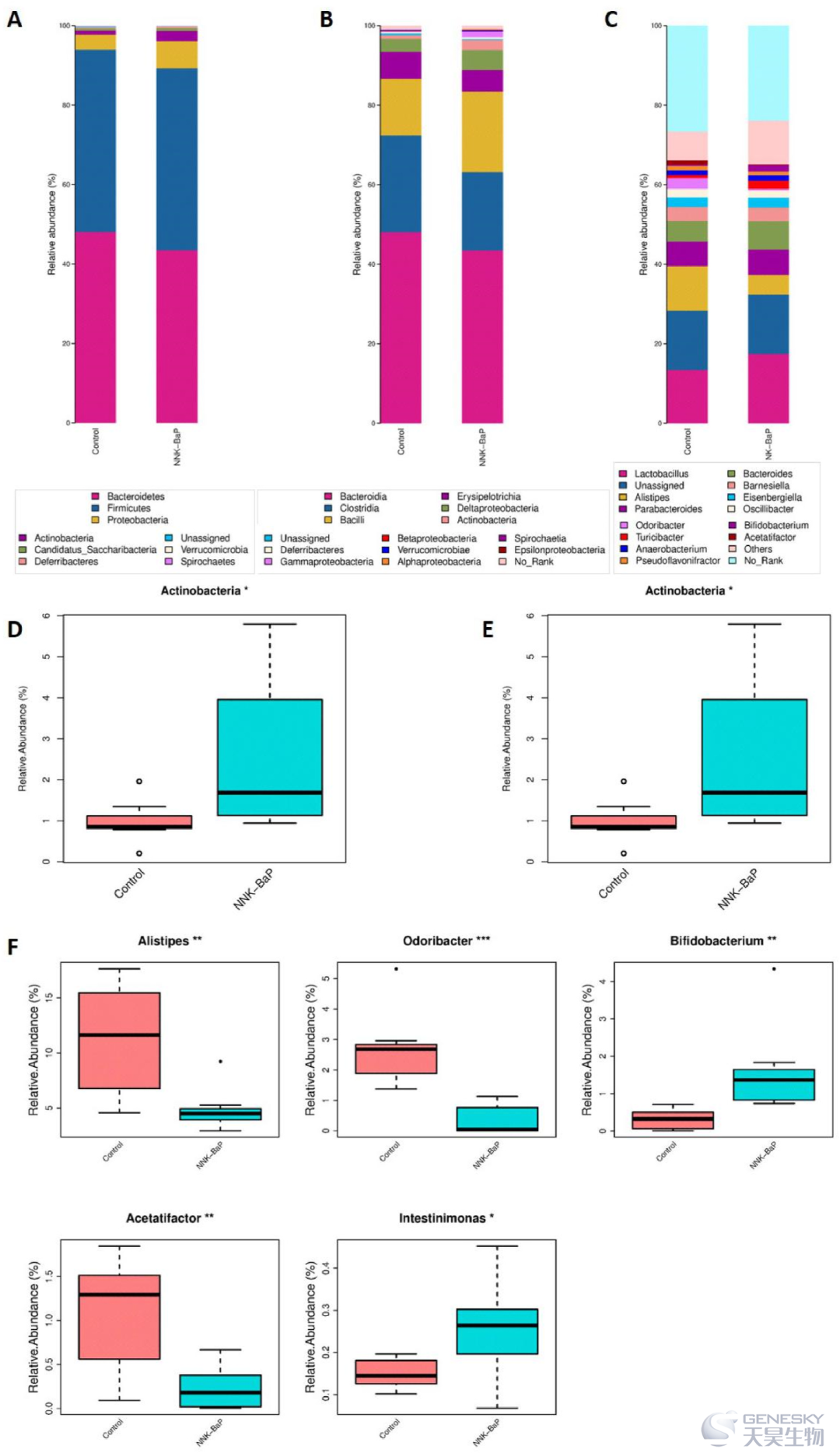
图3、通过16S rRNA基因测序评估各组肠道微生物群落。NNK加BaP降低了微生物物种丰富度和不同分类水平上的微生物群落失调。
为了评估两组之间微生物群落结构的变化,本研究进行了微生物α多样性分析(图4)。稀疏曲线表明,与NNK-BaP组相比,对照组曲线趋于陡峭,说明对照组OTUs的数量明显高于NNK-BaP组。秩-丰度曲线可以代表样品中物种的丰度和均匀度。NNK-BaP组的曲线下降速度快于对照组,表明物种丰富度较低。
α多样性的分析结果表明,在包括ACE和观察物种在内的丰富度指数方面,NNK-BaP组的肠道微生物群落的α多样性低于对照组。然而,肺癌组和健康对照组在Chao1、Shannon、Simpson和Coverage之间没有显著差异。
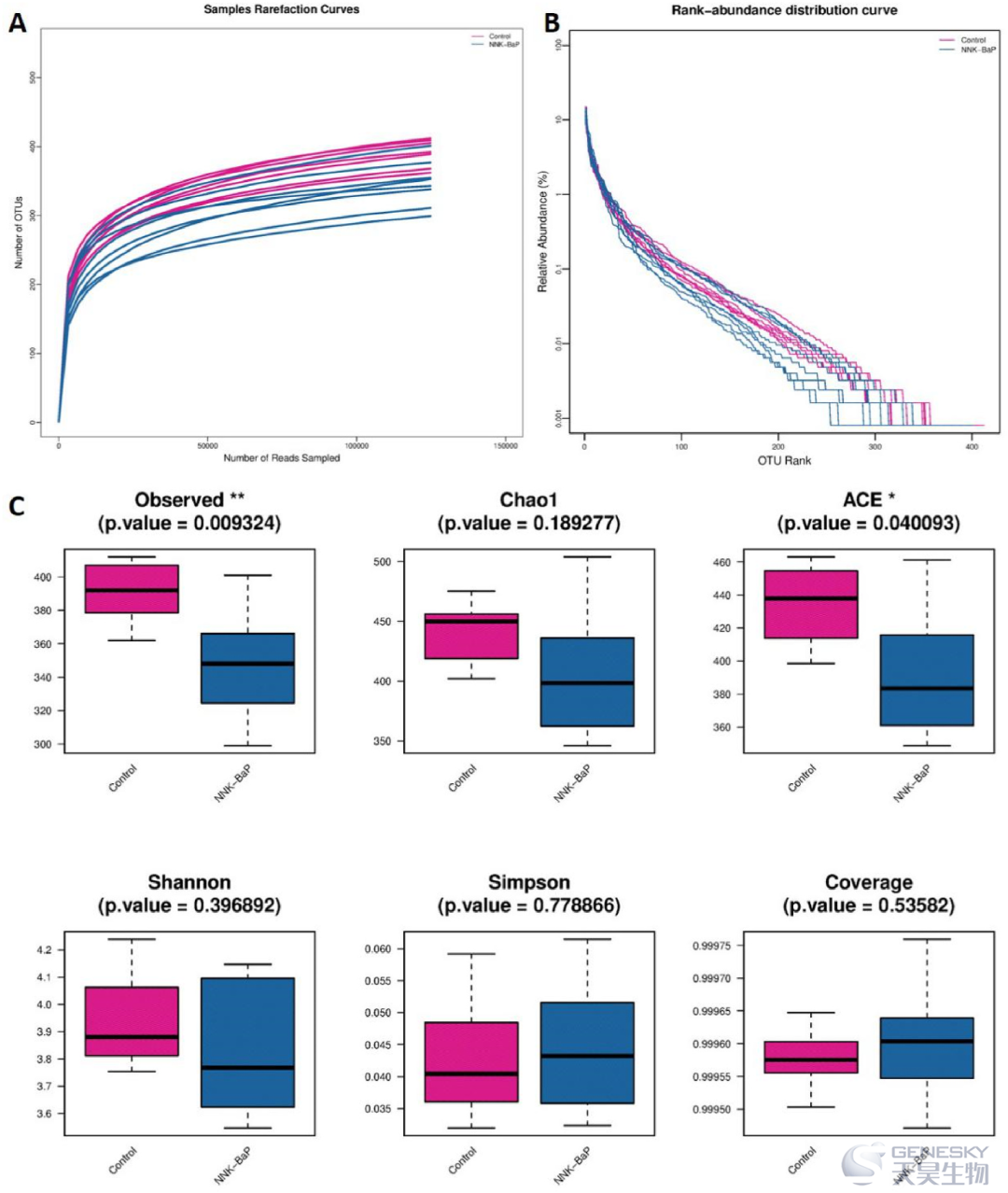
图4、α多样性曲线。(A)稀疏曲线,(B)秩-丰度曲线和(C)各组之间肠道微生物群α多样性的比较,包括Chao1、Shannon、Simpson、ACE、观察物种和覆盖率。
代表β多样性的PCA、PCoA和NMDS的结果如图5所示,这些结果描述了基于总体OTUs的两组之间的异同。结果显示,与对照组相比,NNK-BaP组均表现出显著性差异。
为了鉴定NNK-BaP给药后的特定细菌类群,通过LEfSe分析比较各组间的微生物组组成(图5D),可以显示物种分类信息和种群内物种的丰度差异。进化分支图从中心向外分别在分类学上代表门、纲、目、科、属和种。在每个分类水平上代表一个物种的每个节的大小与物种的丰度正相关。黄色节点代表没有显著差异的物种。分支图分析表明,从两个实验组中共选出35个分类群,不同组间的肠道细菌种类组成存在显著差异。此外,LDA还鉴定出两组间差异显著的主要分类群。
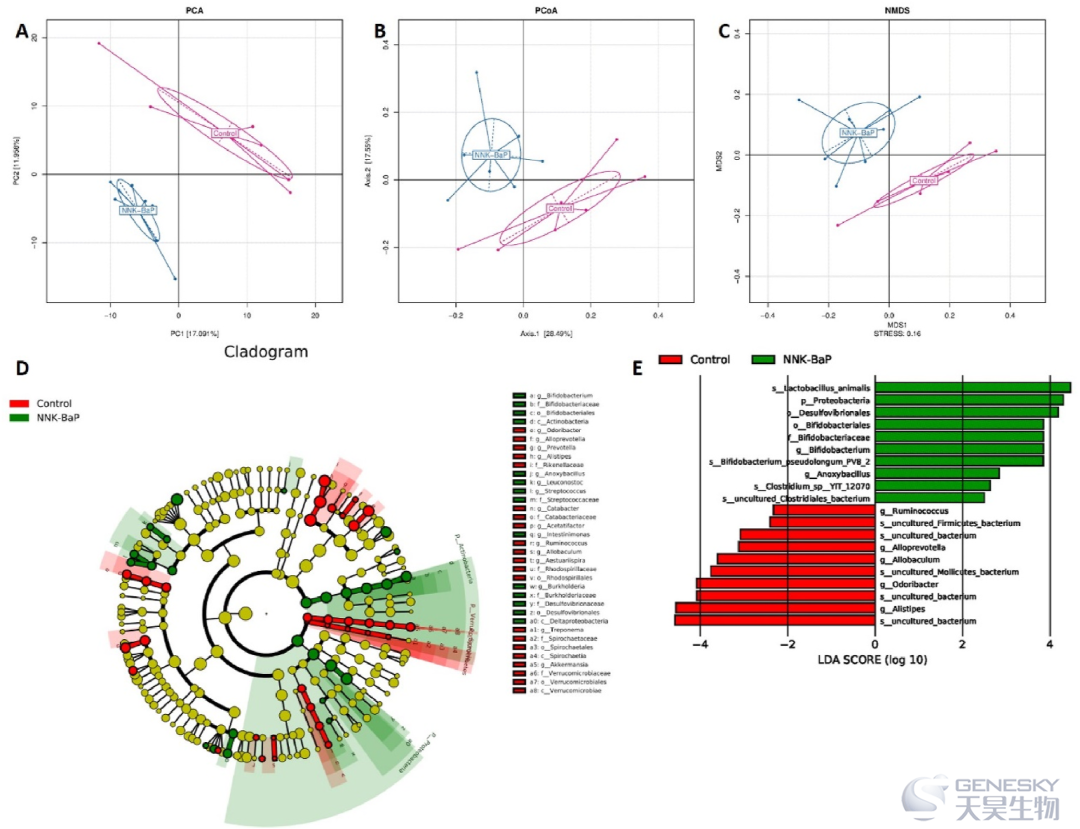
图5、β多样性分析。(A) PCA、(B) PCoA和 (C) NMDS分析,(D)从LEfSe分析得到的分支图揭示了每组中不同的微生物分类群,(E)各组线性判别分析得分直方图。
利用PICRUSt分析探讨肠道细菌组成改变引起的KEGG通路的改变。与对照组相比,NNK-BaP组有24条功能途径存在显著差异 (图6)。.
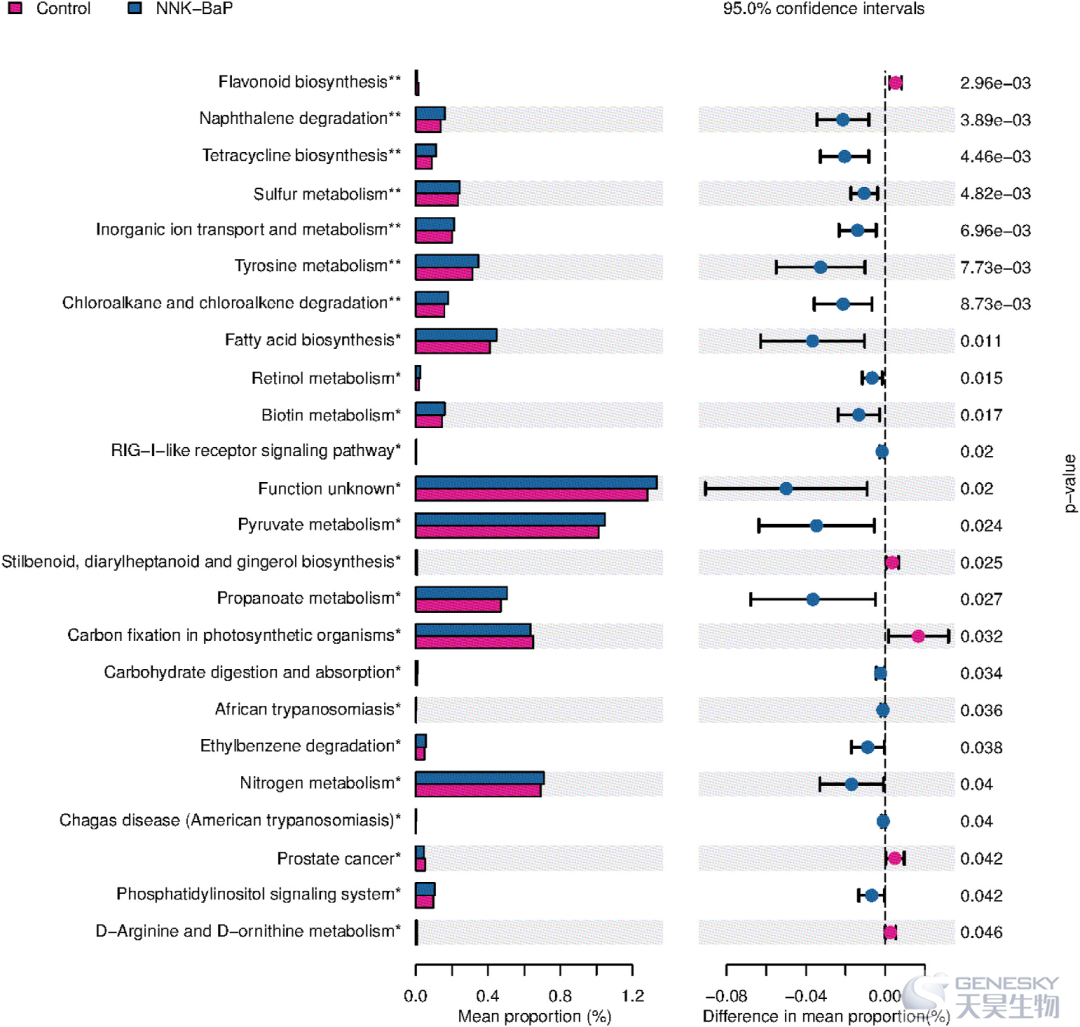
图6、基于KEGG途径的PICRUSt分析对两组小鼠肠道微生物群进行功能预测。柱的长度代表每个样品组中代谢途径的平均相对丰度。中间区域是置信区间,表示两组之间物种丰度百分比的差异。最右边是P值,P < 0.05被认为具有统计学意义。
为探讨NNK-BaP对肺癌小鼠粪便代谢变化的影响,研究者进行了代谢组学分析(图7)。收集实验组的粪便样本,通过UPLC-QTOF-MS进行非靶向代谢组谱分析。使用有监督的OPLS-DA方法进行分析。结果显示,NNK-BaP组和对照组之间有明显的分离。NNK-BaP组与对照组比较,共有70种代谢物出现显著差异(VIP > 1.00,调整后P < 0.01)。
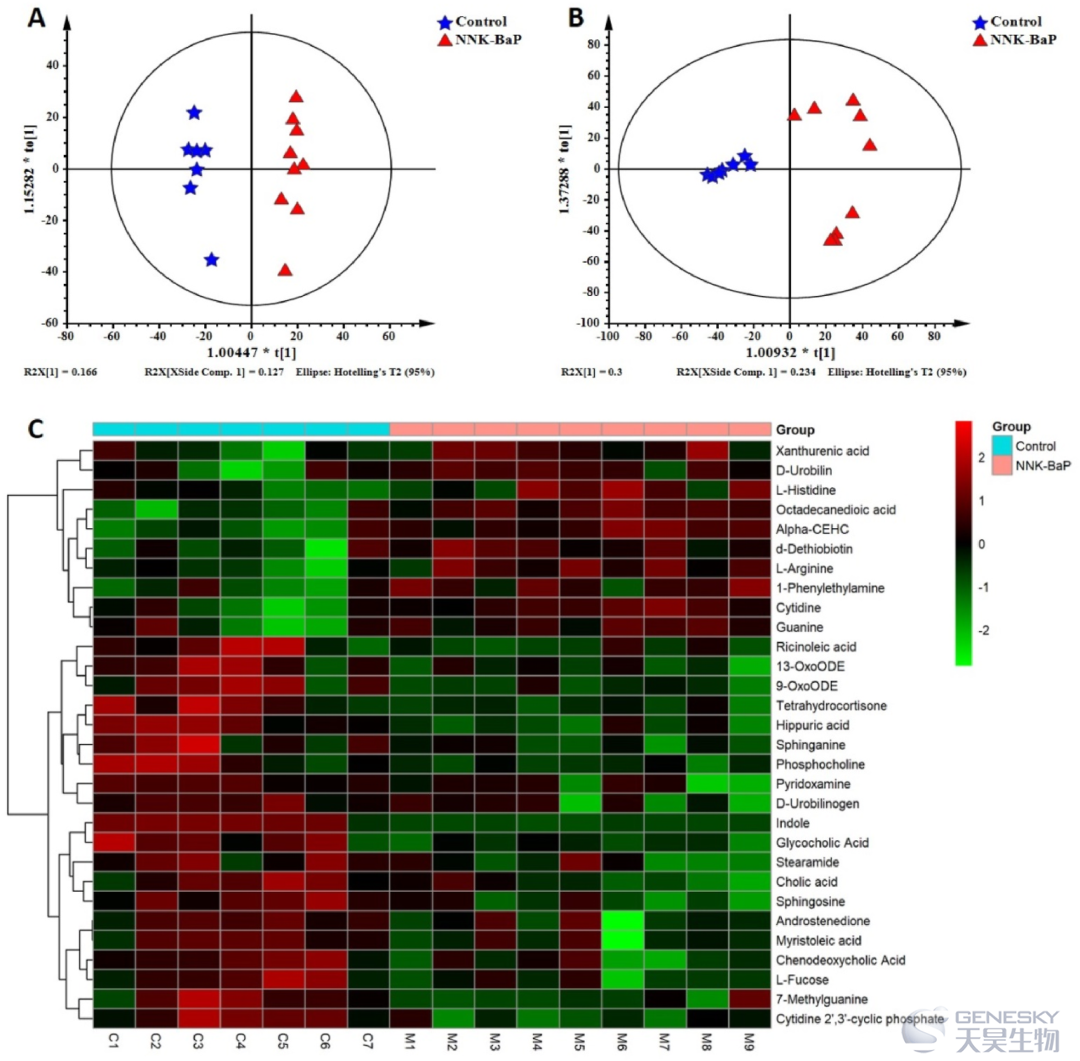
图7、通过非靶向代谢组学分析NNK-BaP处理下的A/J小鼠的粪便代谢物谱。
肺癌小鼠粪便代谢组学变化与肠道细菌组成的相关性分析
为了进一步研究粪便代谢物和粪便微生物群之间的关系,研究者构建了基于spearman系数的相关矩阵(图8)。结果发现,双歧杆菌、肠杆菌、阿利斯替普斯菌、臭杆菌、醋酸杆菌和显著差异代谢物之间有很强的相关性。
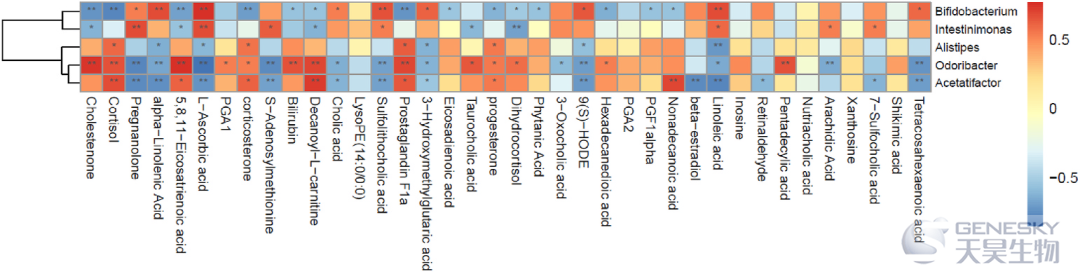
图8、肠道微生物群和不同粪便代谢物之间的相关性热图。X轴代表不同代谢物,Y轴代表肠道微生物群。
本研究发现放线菌、双歧杆菌和肠杆菌水平的升高,以及理研菌、内脏异味杆菌和Acetatifactor菌水平的降低与NNK加BaP触发的肺癌有关。代谢组学图谱揭示了相关的代谢调控,包括嘌呤代谢、苯丙氨酸代谢、初级胆汁酸生物合成、类固醇激素生物合成、不饱和脂肪酸生物合成、亚油酸代谢等。本文的结果可以为使用肠道微生物作为生物标志物来评估肺癌的进展提供一些指导,并为未来控制该疾病的发展带来了干预靶点。
咨询沟通请联系
18964693703(微信同号)

创新基因科技,成就科学梦想

 咨询热线:400-065-6886
咨询热线:400-065-6886

 咨询热线:400-065-6886
咨询热线:400-065-6886










