
近期,来自吉林大学中日联谊医院科研中心姜金兰主任团队的科研人员,在国际知名学术期刊《Biomedicine & Pharmacotherapy》上发表研究论文。该研究利用天昊微生物16S扩增子测序和非靶向代谢组等检测方法,探讨了肠道微生物群的生态失调对MSCs-exo治疗的影响,并发现使用抗生素将改善其治疗效果。本研究结果进一步鼓励了新型疗法的研究,将使更多的AD患者从中受益。

![]()
英文题目:Depletion of gut microbiota resistance in 5×FAD mice enhances the therapeutic effect of mesenchymal stem cell-derived exosomes中文题目:5×FAD小鼠肠道菌群抗性的消除增强了间充质干细胞来源外泌体的治疗效果期刊名称:Biomedicine & Pharmacotherapy![]()
阿尔茨海默病(AD)是一种常见且致命的神经退行性痴呆。散发性阿尔茨海默病的病因尚不清楚。研究表明,AD发病机制可能由多种因素诱发,例如异常淀粉样蛋白β(Aβ)沉积、tau蛋白过度磷酸化引起的神经源性纤维缠结、神经炎症反应、线粒体功能障碍和异常突触转导功能。然而,将实验室开发的有效AD治疗转化为临床应用仍然是一个重大挑战,开发新的AD治疗策略至关重要。
近年来,干细胞疗法为AD患者带来了希望。干细胞是一类未分化的细胞,可以自我复制并具有很高的再生能力。间充质干细胞(MSCs)是治疗神经退行性疾病的潜在疗法,它可以通过旁分泌产生和分泌许多细胞外囊泡(EV)。MSCs衍生的外泌体(MSCs-exo)具有与MSCs相似的免疫调节和再生修复潜力,但更稳定且更容易保存。MSCs-exo促进Aβ降解,调节免疫反应,防止神经损伤,促进轴突生长,改善认知障碍;然而,确切的机制尚不清楚。
多样化的肠道微生物群落对于维持微生物稳态和黏膜屏障的完整性至关重要。肠道微生物群可能参与神经系统功能和行为的调节。此外,肠道微生物群通过维持中枢神经系统的免疫稳态,对大脑功能调节至关重要。越来越多的证据表明,肠道菌群的改变与AD有关,微生物群失调可以增加肠道通透性,促进全身炎症和免疫反应,并增加血脑屏障通透性。这会导致神经炎症和淀粉样斑块沉积,最终诱发AD。研究发现,移植5×FAD小鼠的肠道微生物群会损害C57BL/6小鼠的记忆功能和神经发生。
因此,我们假设AD的肠道微生物群会影响MSCs-exo的治疗效果,尽管其因果关系和潜在机制尚不清楚。在我们的研究中,我们专注于宿主生态失调肠道微生物群对MSCs-exo治疗AD的影响。
实验首先从人脐带组织中获取MSC,并通过染色及流式细胞术分析进行鉴定确认。之后从MSC培养上清液中分离MSCs-exo。通过纳米颗粒跟踪分析(NTA)测量外泌体的大小和浓度,并使用透射电子显微镜(TEM)对外形进行质检。然后利用蛋白质印迹,对外泌体标志物进行检测。用MSCs-exo对 Aβ1–40处理的SH-SY5Y细胞进行处理,并用共聚焦激光扫描显微镜(CLSM)观察细胞外外泌体的摄取,以及细胞增殖测定、细胞迁移测定和免疫荧光检测。
动物实验选择4月龄的C57BL / 6和5×FAD雌性小鼠进行。一组5×FAD小鼠静脉注射PBS(5×FAD组),另一组静脉注射MSCs-exo(MSCs-exo组)。实验还共同安置了5×FAD小鼠和MSCs-exo处理的5×FAD小鼠(同笼饲养组),以检测AD中肠道微生物群紊乱对MSCs-exo治疗的影响。为了消耗AD中的肠道微生物群,5×FAD小鼠在饮用水中接受广谱抗生素混合物(Abx,万古霉素(0.5mg / mL),新霉素(1mg / mL),甲硝唑(1mg / mL)和氨苄西林(1mg / mL))1周,并静脉注射MSCs-exo(MSCs-exo + Abx组)。针对小鼠的AD表型,本文进行了情境恐惧条件反射 (CFC) 测试、莫里斯水迷宫 (MWM)测试,并对小鼠大脑组织进行了HE 等染色,以及针对淀粉样斑块的免疫组织化学,用ELISA试剂盒测试小鼠血清和海马体中Aβ1-40和Aβ1-42的水平。最后还对胶质原纤维酸性蛋白 (GFAP)进行了染色。
小鼠粪便送上海天昊生物进行微生物16S扩增子测序(V3-V4)和非靶向代谢组检测及生信分析。
MSCs通过三系分化潜力和细胞的表面标志物进行鉴定。诱导MSCs分化为脂肪细胞后观察到细胞内脂滴(图1A)。诱导MSCs成骨分化后,可见红色钙结节(图1B)。此外,取下形成的软骨球的切片,并在阿利新蓝染色后显示蓝色(图1C)。流式细胞术分析显示,MSCs阳性表达CD90,CD105和CD73,但阴性表达CD11b,CD19,CD34,CD45,HLA-DR(图1D)。使用超速离心方法从培养的MSCs的上清液中分离MSCs-exo。透射电子显微镜显示,可见外泌体的双层生物膜结构,外泌体尺寸大多为50-150 nm(图1E)。MSCs-exo的平均尺寸分布为125 nm(图1F)。通过蛋白质印迹分析检测外泌体特异性标志物,结果显示所制备的MSCs-exo外泌体的特征标志物CD9、TSG101呈阳性,钙连蛋白Calnexin呈阴性(图1G)。

![]()
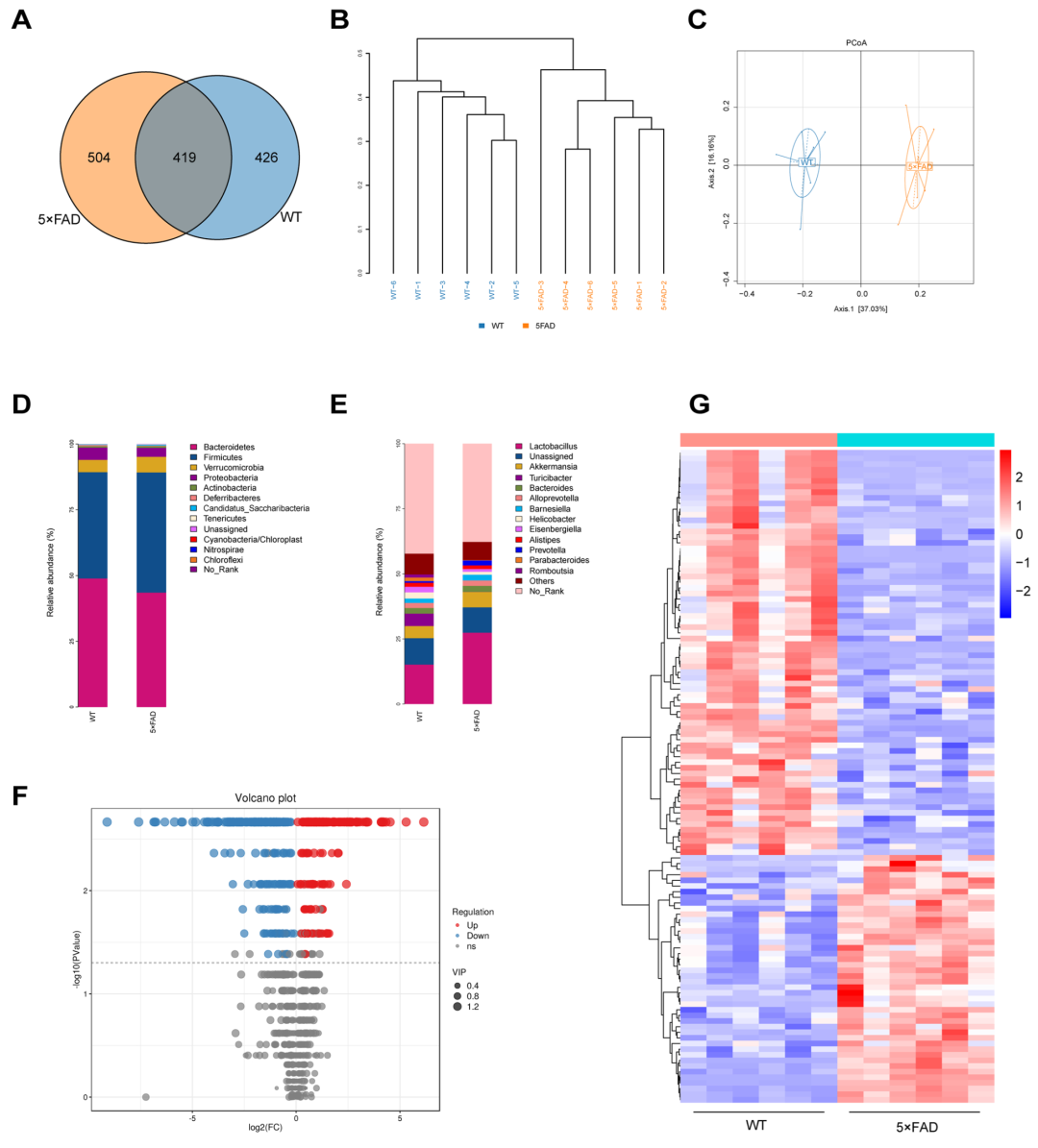
MSCs-exo对 Aβ1–40处理过的SH-SY5Y细胞具有保护作用使用荧光探针DiO进行外泌体标记,来评估MSCs-exo对 Aβ1–40处理过的SH-SY5Y细胞的保护作用。结果显示MSCs-exo显著增强Aβ1–40处理的SH-SY5Y细胞的增殖和迁移。此外,MSCs-exo减少了Aβ在Aβ1–40处理过的SH-SY5Y细胞中的积累。这些发现表明MSCs-exo对Aβ1–40处理过的SH-SY5Y细胞具有保护作用。肠道微生物群和相关代谢物参与神经发育、神经系统的生理功能和神经系统疾病的发展。本文研究了5×FAD小鼠的肠道微生物群组成,以确定其神经病理学变化是否与肠道微生物群的变化相关。实验收集小鼠的粪便进行16 s rRNA测序,并分析野生型(WT)和5×FAD小鼠肠道特异性OTU(图2A)。聚类分析显示,5×FAD小鼠与WT小鼠差异显著(图2B)。基于主坐标分析结果显示组间存在显著性差异,表明5×FAD小鼠肠道菌群已改变(图2C)。在门和属水平上样本的群落结构结果发现,5×FAD和WT小鼠的肠道微生物群组成存在差异。在门水平上,5×FAD和WT小鼠肠道微生物群的分类分布发生了显着变化,两个优势门厚壁菌门和拟杆菌门的变化证明了这一点(图2D)。在属水平上,Akkermansia、Prevotella在5×FAD小鼠中增加(图2E)。研究表明,由异常肠道微生物群引发的代谢物变化可能直接或间接影响AD的发生和进展。研究者使用非靶向液相色谱-质谱方法检查了小鼠粪便样品中微生物群代谢物的变化。火山图显示5×FAD和WT小鼠之间的代谢物存在显着差异(图2F)。与WT小鼠相比,5×FAD小鼠中116种代谢物显著性改变(图2G)。
![]()
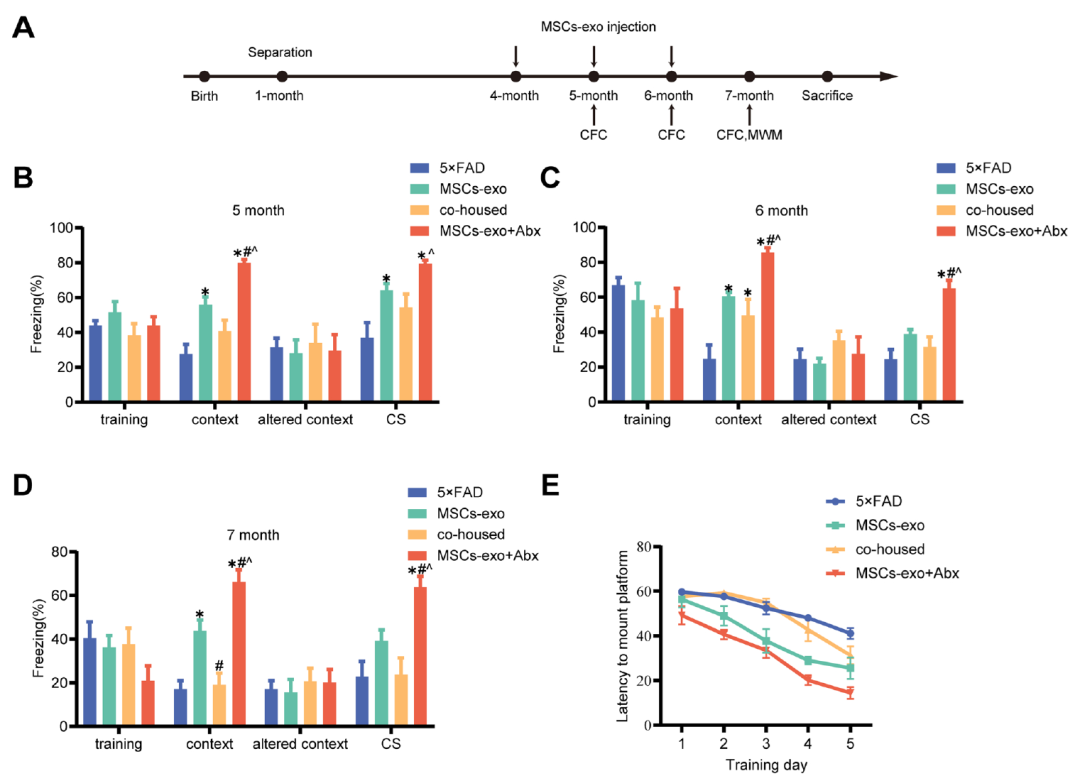
图2、5×FAD小鼠肠道微生物群和相关代谢物的改变。(A)维恩图显示了WT和5×FAD组中OTU的数量。(B) 分层聚类树。(C)PCoA分析。(D)肠道微生物群在门水平上相对丰度的分布。(E)肠道微生物群在属水平上的相对丰度分布。(F)火山图表示上调(红色)和下调(蓝色)代谢物。(G)WT和5×FAD组之间的差异代谢物。(原文图3)用MSCs exo+Abx处理的 5×FAD 小鼠的空间学习和记忆功能改善我们使用4月龄的5×FAD转基因小鼠模型进行动物体内实验,因为5×FAD转基因小鼠广泛用于AD研究,并在第二个月表现出淀粉样蛋白沉积,在第四个月显示突触变性(图3A)。使用CFC和MWM对所有小鼠进行测试,以评估MSCs-exo是否可以改善AD小鼠的空间学习和记忆认知。CFC实验显示,与5×FAD小鼠相比,MSCs-exo处理后恐惧冻结的小鼠百分比增加(图3B-D)。MWM定位导航实验表明,MSCs-exo处理降低了AD小鼠的逃逸潜伏期(图3E)。通过移除隐藏平台并记录实验小鼠在60 s内的运动轨迹进行了空间探索实验。MWM空间探索实验表明,经过MSCs-exo处理后,目标象限中穿越原始隐藏平台的次数和移动距离和时间百分比均优于5 ×FAD组。然而,MSCs-exo治疗和与PBS处理的AD小鼠同笼饲养导致显著的空间记忆缺陷。由于同笼饲养的小鼠以彼此的粪便为食,因此它们可以获得彼此的肠道微生物群,因此MSCs-exo处理的5×FAD小鼠可以从PBS处理的5×FAD小鼠中获得肠道微生物群。在本研究中,同笼组比MSCs-exo组表现出显著的空间记忆缺陷。AD紊乱的肠道微生物群可能会抵抗MSCs-exo的治疗,而减少肠道微生物群抵抗可能会增强MSCs-exo的治疗。因此,文章对AD小鼠施用抗生素以减少耐药性。行为实验表明,MSCs-exo在应用Abx后比单独使用MSCs-exo治疗更显着地改善AD小鼠的空间学习和记忆认知。
![]()
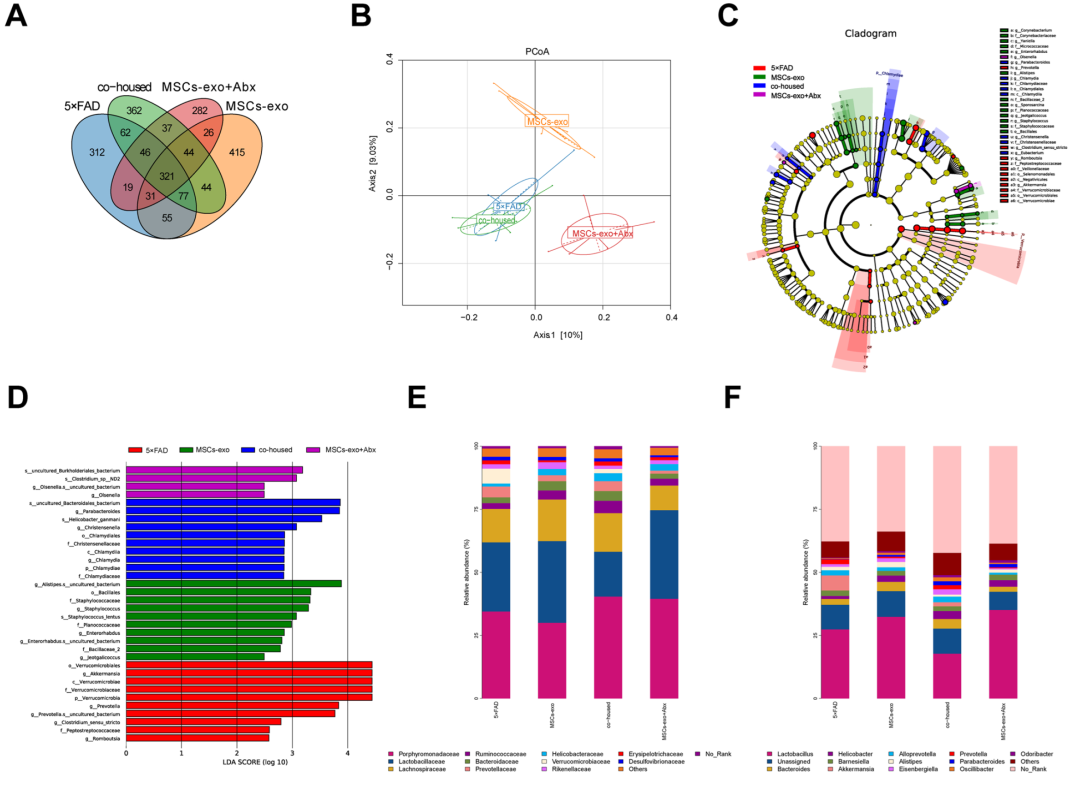
图3、MSCs-exo+Abx治疗进一步改善了5×FAD小鼠的空间学习和记忆功能。(原文图4)随后,研究通过检测MSCs-exo+Abx 对 5×FAD 小鼠神经病理学的影响,发现HE染色显示5×FAD小鼠的锥体细胞层变薄,核固定,海马神经元细胞形态不规则,丢失增加。与模型组相比,MSCs-exo组海马神经元凋亡逆转,海马神经元丢失显著减少。NISSL染色也表明模型组锥体细胞分布稀疏,细胞轮廓模糊,神经元损伤明显。相比之下,MSCs-exo治疗后神经元形态更完整。同笼组神经元损伤明显,MSCs-exo+Abx组神经元凋亡减少,形态结构完整,细胞边界清晰,细胞质丰富。免疫组织化学染色显示,与5×FAD小鼠相比,MSCs-exo组斑块沉积减少,同笼组斑块沉积增加。MSCs-exo +Abx组的斑块沉积低于MSCs-exo处理组。抗生素处理通过改变肠道微生物群和相关代谢物来增进 MSCs-exo 治疗效果本研究通过16S rRNA 测定,进一步阐明通过抗生素治疗增强了 MSCs-exo 对 5×FAD 小鼠症状的改善。基于OTUs聚类,分析了组间小鼠肠道特异性OTU。5×FAD组、同笼饲养组、MSCs-exo组 和 MSCs-exo+Abx 组特有的 OTU 数量分别为 312、362、415 和 282,所有四个组共有 321 个 OTU(图 4A)。主坐标分析表明,同笼组的肠道微生物群结构与5×FAD组相似,而MSCs-exo和MSCs-exo+Abx组与5×FAD组相比,肠道微生物群结构存在一定差异(图4B)。LefSe分析用于识别明显不同的细菌组,以确定特定细菌组在组间是否具有差异富集性(图4C,D)。这些结果表明,肠道微生物群失调可能会削减MSCs-exo的治疗效果,而降低AD中肠道微生物群的抗性可能会增强MSCs-exo的治疗效果。
![]()
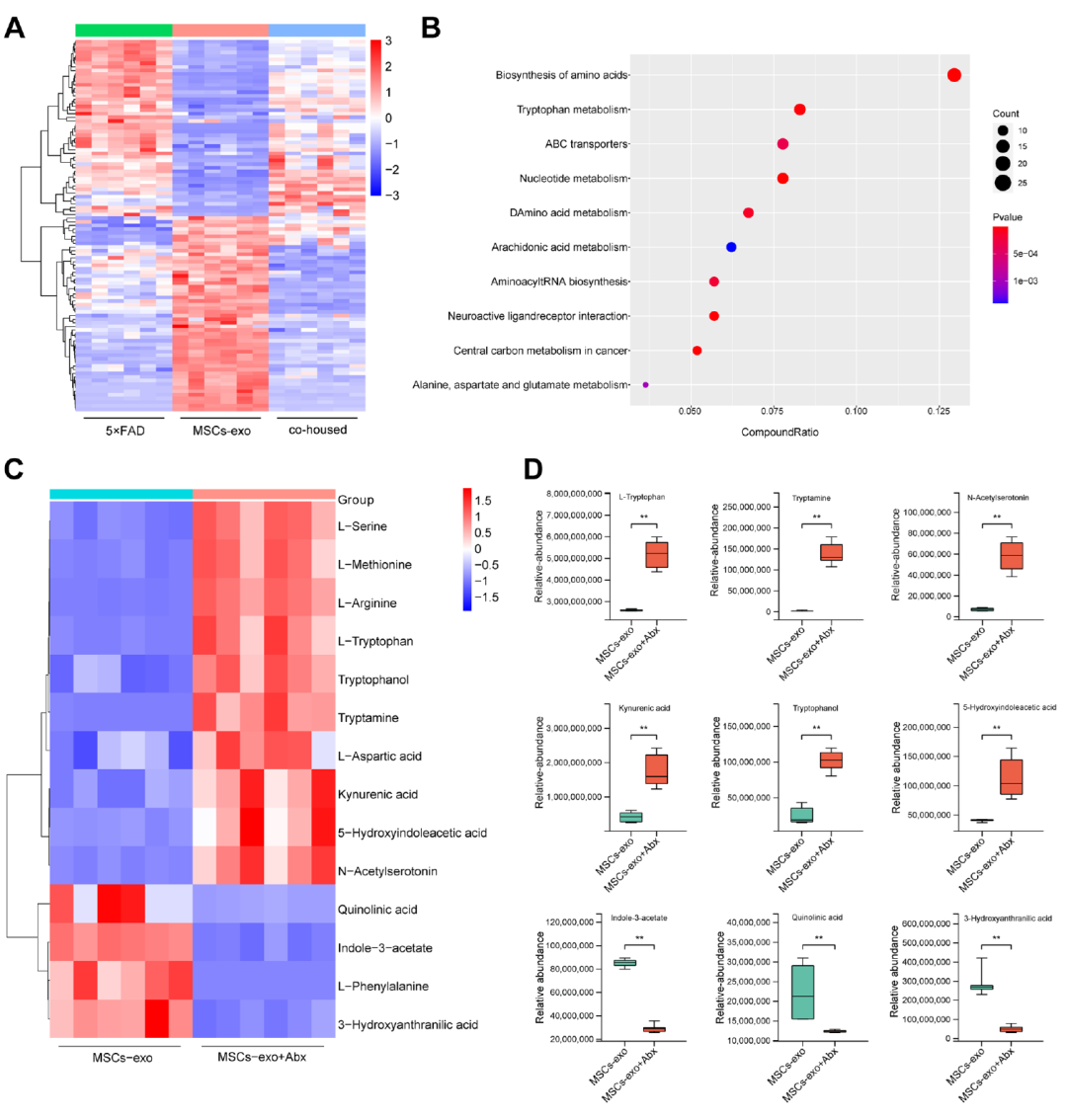
图4、抗生素处理可以通过改变肠道微生物群来增强MSCs-exo治疗效果。(原文图7)研究使用非靶向液相色谱-质谱法检测小鼠粪便样品中微生物群代谢物的变化,发现MSCs-exo处理小鼠的微生物代谢物与5×FAD小鼠的微生物代谢物之间存在显著差异(图5A),而同笼饲养减少了这些差异。为了研究Abx处理如何增强MSCs外泌体的治疗效果,研究分析了MSC-exo-和MSCs-exo+Abx处理小鼠的差异代谢物,并进行了KEGG富集分析(图5B)。结果发现改变的代谢物富集在不同的代谢组学信号通路中,氨基酸的生物合成和色氨酸代谢高度富集。参与氨基酸合成的几种代谢物发生显著改变,包括L-丝氨酸、L-蛋氨酸、L-精氨酸、L-天冬氨酸、L-苯丙氨酸和色氨酸(图5C)。与单独MSCs-exo处理的小鼠相比,MSCs-exo+Abx组处理的小鼠中L-色氨酸,色胺,犬尿酸,N-乙酰血清素,色氨酸和5-羟基吲哚乙酸的水平上调,而喹啉酸,3-羟基邻氨基苯甲酸和吲哚-3-乙酸盐的水平下调(图5D)。
![]()
图5、抗生素处理通过改变代谢物来增强MSCs-exo治疗效果。(原文图8)
本研究证实AD紊乱的肠道微生物群可以消弱MSCs-exo的治疗效果,而抗生素调节失调的肠道微生物群和相关代谢物可以增强MSCs-exo的治疗。本研究结果将鼓励研究新型疗法,以增强MSCs-exo对AD的治疗,并为通过调节肠道微生物群和相关代谢物来增强MSCs-exo治疗提供基础,这可能使更广泛的AD患者受益。在肠道微生物群失调或对MSCs-exo治疗无响应的患者中,调节肠道微生物群可能有助于获得更好的治疗结果。然而,本研究仅在动物身上进行,需要进一步的临床试验来阐明MSCs-exo联合Abx治疗的疗效,这将扩大其未来临床应用的前景,并使更广泛的患者受益。

 咨询热线:400-065-6886
咨询热线:400-065-6886

 咨询热线:400-065-6886
咨询热线:400-065-6886








