今天给大家介绍一篇2022年2月刚刚发表在国际权威学术期刊《Microbiome》上的文章,该研究利用根际土壤微生物16S扩增子、宏基因组与宿主转录组和DNA甲基化表观修饰联合分析的方法,探讨了外源接种物、微生物组和植物宿主之间的三方互动关系,明确了植物生长促进菌(PGPB)在根部诱导的DNA甲基化修饰介导了促进过程,而且这些修饰在微生物群落中的接种物消除后仍然具有功能性。下面我们就简单看一下这篇文章。

英文题目:Long-term effect of epigenetic modification in plant–microbe interactions: modification of DNA methylation induced by plant growth-promoting bacteria mediates promotion process
中文题目:表观遗传修饰对植物-微生物相互作用的长期影响:植物生长促进菌诱导的 DNA 甲基化修饰介导促进过程
期刊名:Microbiome
发表时间:2022年2月24日
影响因子:14.650
背景:土壤微生物组被认为是下一次绿色革命的基石,植物生长促进菌 (PGPB) 对微生物组工程至关重要。然而,有益植物的微生物从发现到农业应用仍然具有挑战性,因为天然土壤中有益菌株与植物之间相互作用的机制仍然很大程度上未知。越来越多的研究表明,引入来操纵微生物组的菌株通常在土壤中被消除,而其他人则报告说,将 PGPB 作为接种物应用可显着改善植物生长。这种矛盾表明需要更深入地了解微生物诱导生长促进的机制。结果:我们研究了在土壤中消除 PGPB 接种物后 PGPB 诱导的长期植物生长促进作用,并探索了外源接种物、本地微生物和植物之间的三方相互作用,这是植物生长促进过程的关键要素。我们发现根际微生物的组装主要由植物发育驱动,根系的补充大大减弱了接种物对根际微生物组的影响。根际微生物的变化和根中接种物的定殖都不是促进植物生长所必需的。在根中,DNA 甲基化修饰会影响与 PGPB 诱导的生长促进相关的基因表达,并且接种诱导的 DNA 甲基化模式的破坏大大削弱了植物的生长促进。结论:这项研究提出了一种新的机制,其中 PGPB 影响根中的 DNA 甲基化以促进植物生长,这为微生物组与植物的相互作用提供了重要的见解,并为植物微生物组工程提供了新的策略。
近几十年来,与宿主相关的微生物群落是最重要的发现之一,对宿主至关重要,例如在肠道或根际生长的微生物。土壤微生物组已被认为是下一次绿色革命的基石,因为对植物有益的根际细菌不仅可以减少对环境不友好的农药和农用化学品的依赖,还可以提高作物生产力,从而实现更可持续的农业。在土壤微生物中,植物生长促进细菌 (PGPB) 是工程微生物应用于农业的关键。尽管 PGPB 介导的植物促生长机制尚未完全证实,但许多研究表明,PGPB 可以直接促进植物的养分获取或调节植物激素水平,或通过抑制各种病原体和增强免疫系统,提高抗性来间接影响植物生长环境压力。
由于外源接种物、本土微生物组和植物之间的三者相互作用是植物促生过程开始和持续的关键因素,我们假设以下两种类型的变异可能在这个过程中持续发挥作用:由接种物诱导的植物根际微生物组和/或表观遗传变化。因此,改变的细菌群落,包括许多未培养和未知的菌株,可能参与了促进生长的过程。在植物中,表观遗传修饰在调节基因表达和应对生长发育过程中的生物和非生物胁迫方面发挥着重要作用。一些胁迫诱导的表观遗传修饰可能是稳定和可遗传的,成为植物适应胁迫过程中的表观遗传记忆。然而,迄今为止,很少有研究证明植物中的动态表观遗传修饰对促进生长的活动作出反应。因此,表观遗传修饰在 PGPB 介导的植物生长促进中的作用仍然未知。
DNA甲基化是一种常见的表观遗传调控,主要发生在稳定且易于获得的胞嘧啶残基上。响应刺激的 DNA 甲基化变化可能是持久的,甚至可能传递给后代。在植物中,胞嘧啶甲基化发生在三种不同的序列环境中:胞嘧啶-鸟嘌呤 (CG)、胞嘧啶-H-鸟嘌呤 (CHG) 和胞嘧啶-HH (CHH),其中 H 表示腺嘌呤 (A)、胞嘧啶 (C) 或胸腺嘧啶 (T)。参与 DNA 甲基化维持的机制已得到充分证明。CG 环境中的胞嘧啶修饰由甲基转移酶 1 维持,CHG 环境中的那些由铬甲基化酶 2 (CMT2) 或 3 维持,而 CHH 环境中的那些由结构域重排的甲基化酶 2 或 CMT2 维持。DNA 去甲基化由一个 DNA 糖基化酶家族催化,包括沉默阻遏物 1、demeter 和 demeter 样 2 和 3。尽管在了解响应环境刺激调节 DNA 甲基化的分子机制方面取得了巨大进展,但大多数研究使用模式植物,特别是拟南芥,因此 DNA 甲基化如何介导原生植物在其自然栖息地的应激反应在很大程度上是未知的。
商陆 ( Phytolacca americana L.) 是北美本土多年生草本植物,能够在许多栖息地繁衍生息,已成为中国常见的外来入侵物种。P. americana是一种 Mn/Cd 超富集植物,在重金属 (HM) 污染土壤的生物修复方面具有巨大潜力。为了促进 HM 超富集植物在生物修复中的使用,有人提出了微生物辅助植物修复的策略。在这里,我们分离了两个PGPB,芽孢杆菌Bacillus sp. PGP5和节杆菌属Arthrobacter sp.PGP41来辅助植物对HM环境的修复。我们之前的研究表明,遗传变异不太可能是商陆广泛生态分布的原因,而表型可塑性在其对不同环境的响应中起主要作用。由于表型可塑性可以通过表观遗传调控来介导,因此当商陆暴露于外部刺激,例如来自 PGPB 的刺激时,其表观遗传状态可能会改变,从而最终影响植物生长。在这项研究中,我们研究了 PGPB 接种物对植物发育过程中根际微生物组组装的影响,接种和未接种根际微生物组之间的分类和功能差异,以及 DNA 甲基化在 PGPB 介导的植物生长促进中的作用。接种任一菌株均显着增加了商陆的生长。通过扩增子或宏基因组测序在分类和功能水平上分析了接种后根际微生物组的演替动态。同时,分别通过转录组测序和全基因组亚硫酸氢盐测序,评估了PGP5和PGP41接种后,商陆中基因表达和DNA甲基化的变化。用 DNA 甲基化抑制剂 zebularine (Zeb) 处理植物后,进一步研究 DNA 甲基化在促进生长过程中的作用;同时,还利用无菌土壤来研究根际微生物组的作用。最后本文提出了微生物组与植物之间相互作用的两步过程模型;该模型全面记录了根际微生物组和植物的动态调节过程。我们的研究结果为 PGPB 影响 DNA 甲基化以促进植物生长的机制提供了第一个证据,并为微生物工程提供了重要的见解。
本研究中使用的土壤是采集的表层土壤(0-15 cm 深度)。使用两种PGPB菌株接种物:芽孢杆菌Bacillus sp. PGP5和节杆菌属Arthrobacter sp.PGP41进行实验。为了消除植物遗传变异对植物-微生物组相互作用的影响,本研究使用了同一种基因型美洲商陆。我们使用两种PGPB菌株接种四叶期的美洲商陆。
实验设计包括两种接种处理和一种未接种对照处理。处理如下:PGP5(接种PGP5菌株)、PGP41(接种PGP41菌株)和CK(向土壤中加入相同体积的无菌水)。所有处理一式三份进行。在接种后 0、3、7、15、21 和 30 天,对植物和根际土壤进行取样。样品在液氮中冷冻并储存在 –80°C 直至进一步分析。
此外,还用 Zeb 处理以研究 DNA 甲基化在接种诱导中对植物生长促进的作用。幼苗在含有 Zeb (3 μM) 的 Hoagland 营养液中生长 7 天,然后转移到盆中进行进一步的接种处理。并且使用了 qPCR、FISH、GFP 标记菌株和 16S rRNA 基因扩增的组合进行分析。此外,宏基因组分析用于推断接种和未接种根际微生物组功能潜力的差异。在早期(第 3 天)和晚期(第 30 天)阶段收集土壤样本用于宏基因组分析。还对接种后 3 天和 30 天的植物根组织进行RNA-seq 和WGBS分析,获得宿主基因表达和DNA甲基化修饰情况。
为了探索 PGPB 和植物发育对微生物组组装的影响,我们研究了接种和植物栽培处理后 30 天内根际微生物组的变化(图1)。在第 3 天检测到两种接种物(菌株 PGP5 和 PGP41)的高丰度,随后在对照土壤中迅速下降到相同水平,表明接种物未能在土壤中茁壮成长。α-多样性分析揭示了植物发育过程中多样性随时间的变化。与早期(0-7天)相比,后期(15-30天)的α多样性变化更为温和,表明根际微生物组逐渐趋于稳定。β-多样性分析也揭示了类似的结果。我们使用随机森林模型进一步确定了与根停留时间相关的操作分类单位(OTU),并检测到了 13 个 OTU。尽管早期的相对丰度较低,但大多数 OTU 在后期仍处于高水平。在接种处理的样品中也检测到晚期与早期相比较高水平的模式。总之,这些结果表明根际间隔可能对根际微生物组具有募集作用,在根与特定细菌之间形成密切关系后稳定了根际微生物组。
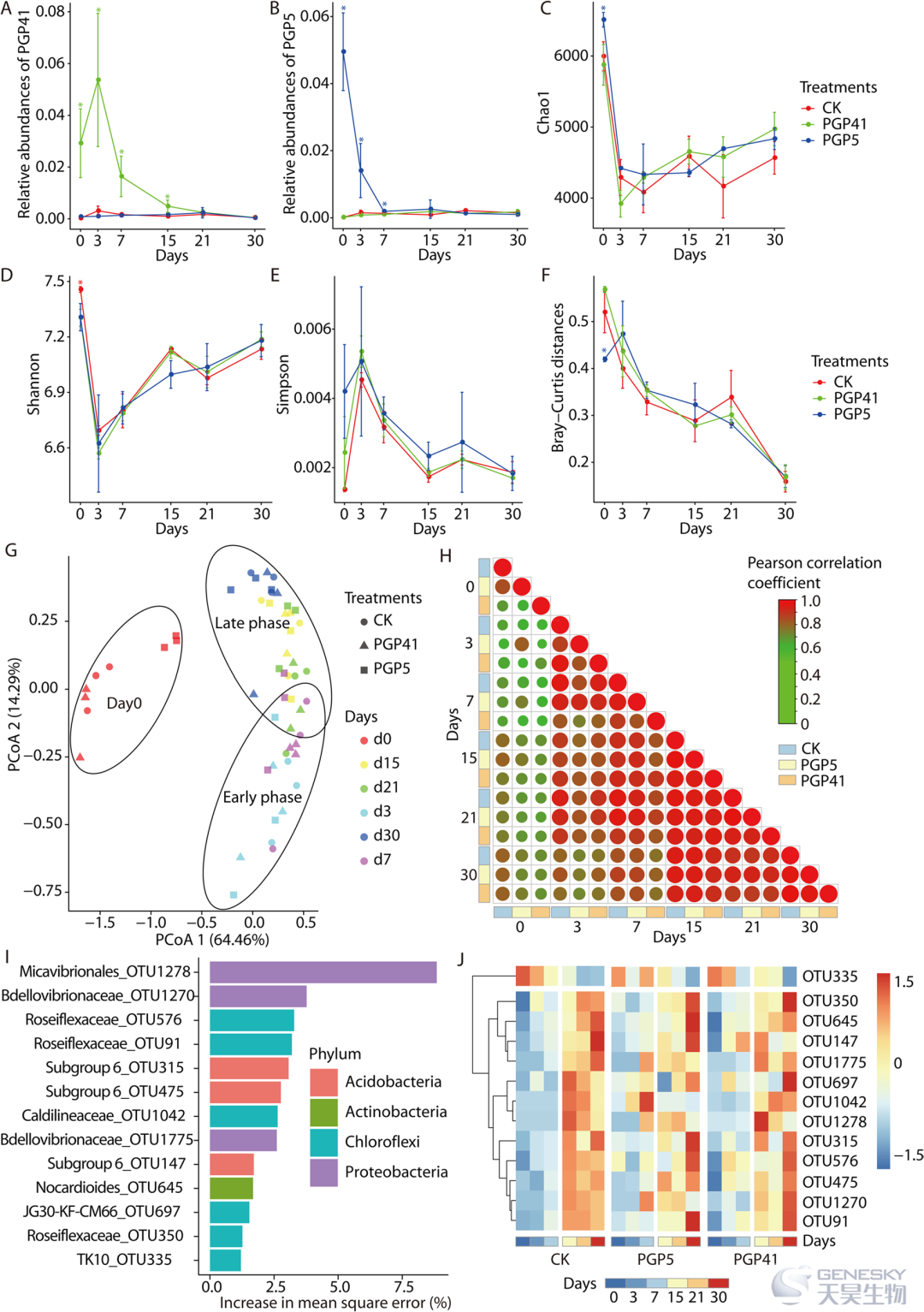
图1、根系诱导的根际微生物区系的分类变异。A、B菌株PGP41( A )和PGP5( B )在根际微生物组OTU中与菌株16s rRNA基因序列100%匹配的相对丰度。C-E) α-多样性指数的变化,包括 Chao1 ( C )、Shannon ( D ) 和 Simpson ( E ) 指数。F) 最后收集的样本(30 天)和每个时间点的样本(0-21 天)的微生物组之间的 Bray-Curtis 距离随着植物的生长和发育而减小。G) PCoA 显示微生物组随植物居住和发育的变化。H) 样本之间的成对相关性显示接种和对照微生物组的变化趋势相似,并且根际微生物组在移植 15 天后变得稳定。负相关和正相关分别以绿色和红色显示。圆圈大小和颜色强度代表相关系数。I) 通过随机森林回归确定的细菌生物标志物在 CK 中的相对丰度与植物驻留时间的关系。J) 基于 CK 和接种(PGP5 和 PGP41)土壤中生物标志物相对丰度的热图显示出相似的变化趋势以及植物在不同土壤中的驻留时间。
尽管根系的驻留和发育是影响根际微生物的主要因素,但在早期阶段就检测到了接种引起的根际微生物的变化(图2)。

图2、接种物诱导的根际微生物组的分类变异。A–C) 根际微生物组的分类差异,用于比较 PGP5-Day 3 与 CK-Day 3 (A)、PGP41-Day 3 与 CK-Day 3 (B)、CK-Day 30 与 CK-Day 3 (C)。最大的圆圈代表领域(细菌和古生菌),内圈代表门、类、科和属。圆圈大小代表不同分类水平下分类群的相对丰度。蓝色圆圈代表 CK 第 3 天显着富集的属;绿色圆圈代表A、B和C中 PGP5-Day 3、PGP41-Day 3 和 CK-Day 30 中显着丰富的属; 黄色圆圈代表非显着富集 (Non-S) 属。D) 早期(顶部)和晚期(底部)未接种微生物组的共现网络。E) PGP41 接种的微生物组在早期(顶部)和晚期(底部)阶段的共现网络。节点指的是OTU;边缘是指显着的相关性。每个节点的颜色表示门;每个节点的大小与度数成正比。OTU 代表菌株 PGP5 和 PGP41(具有 100% 同一性)在网络中被标记。F, G用于比较未接种与 PGP5 接种微生物组的共现网络节点级属性的差异 (F),以及早期未接种与接种 PGP41 的微生物组 (G)。早期样本之间存在显着差异,而晚期样本之间未检测到显着差异。
之后进行宏基因组分析来深入了解根际微生物组之间的功能差异(图3)。结果表明,接种处理诱导的根际微生物的功能水平变化仅限于早期阶段。
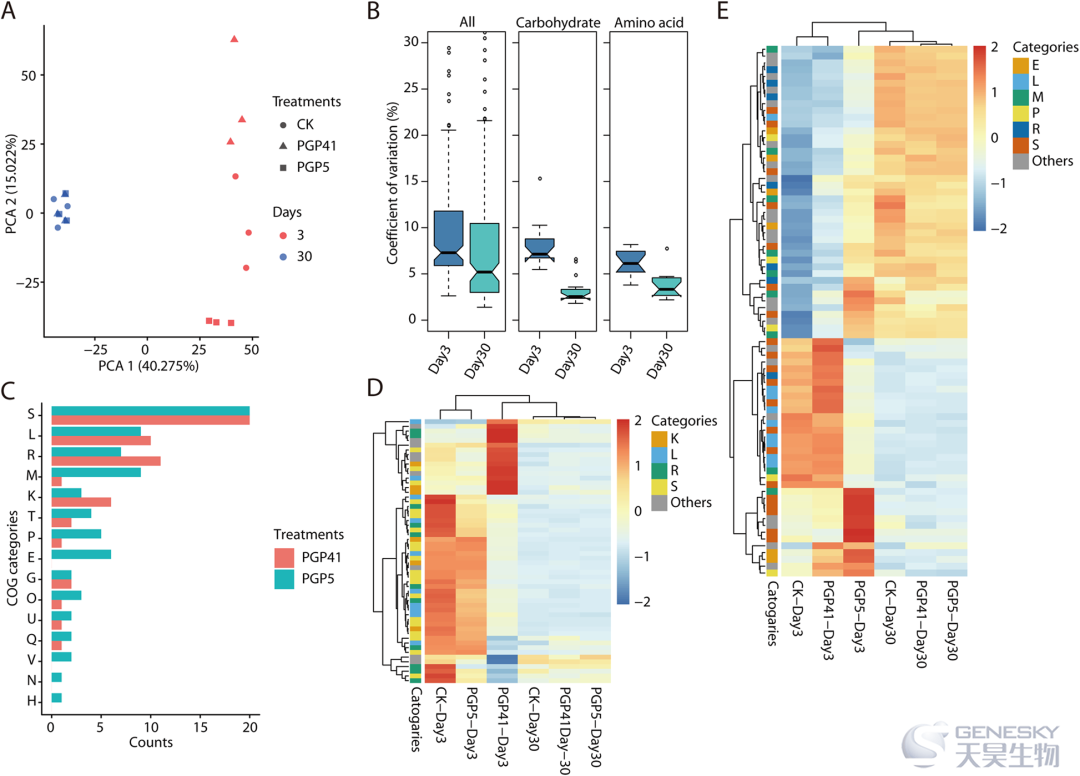
图3、根际微生物组的功能变异。A)PCA显示早期而非晚期接种引起的微生物组变化。B)在早期(第 3 天)和晚期(第 30 天)阶段的所有样本的宏基因组中检测到的 KEGG 类别的变异系数分布;(左)所有 KEGG 类别;(中)与碳水化合物代谢相关的 KEGG 类别;(右)与氨基酸代谢相关的 KEGG 类别。C)与 CK 在第 3 天相比,接种 PGP41 和 PGP5 的微生物组中显着变化的 COG 类别的丰度。D,E)热图描绘了PGP41 和PGP5 接种的微生物组与 CK 的差异。COG类别缩写如下:E,氨基酸转运和代谢;G,碳水化合物的运输和代谢;H、辅酶转运与代谢;K,转录;l、复制、重组、修复;M,细胞壁/膜/包膜生物发生;N,细胞运动性;O,翻译后修饰、蛋白质周转和伴侣;P,无机离子转运和代谢;Q,次生代谢物的生物合成、运输和分解代谢;R,仅一般功能预测;S,功能未知;T,信号转导机制;U,细胞内运输、分泌和囊泡运输;V、防御机制。
我们使用 RNA 测序 (RNA-seq) 来建立在接种和未接种土壤中生长的植物在早期和晚期的基因表达差异模式(图4)。在第 3 天,分别在 PGP5-CK 和 PGP41-CK 比较中检测到总共 20,968 和 11,825 个差异表达基因 (DEG),表明在早期阶段由接种和/或改变的根际微生物组引起的基因表达发生了彻底的变化。在第 30 天检测到的 DEG 数量要少得多,在 PGP5-CK 和 PGP41-CK 比较中分别有 2825 和 1843 个。这些结果表明,后期的 DEGs 可能是由于早期接种的诱导产生的,因为在第 30 天根际微生物组之间没有检测到显着差异。结合在早期也检测到大多数 DEGs 及其在晚期显着富集的功能的结果,这些结果表明微生物组诱导的根基因表达变化选择性地维持到晚期。
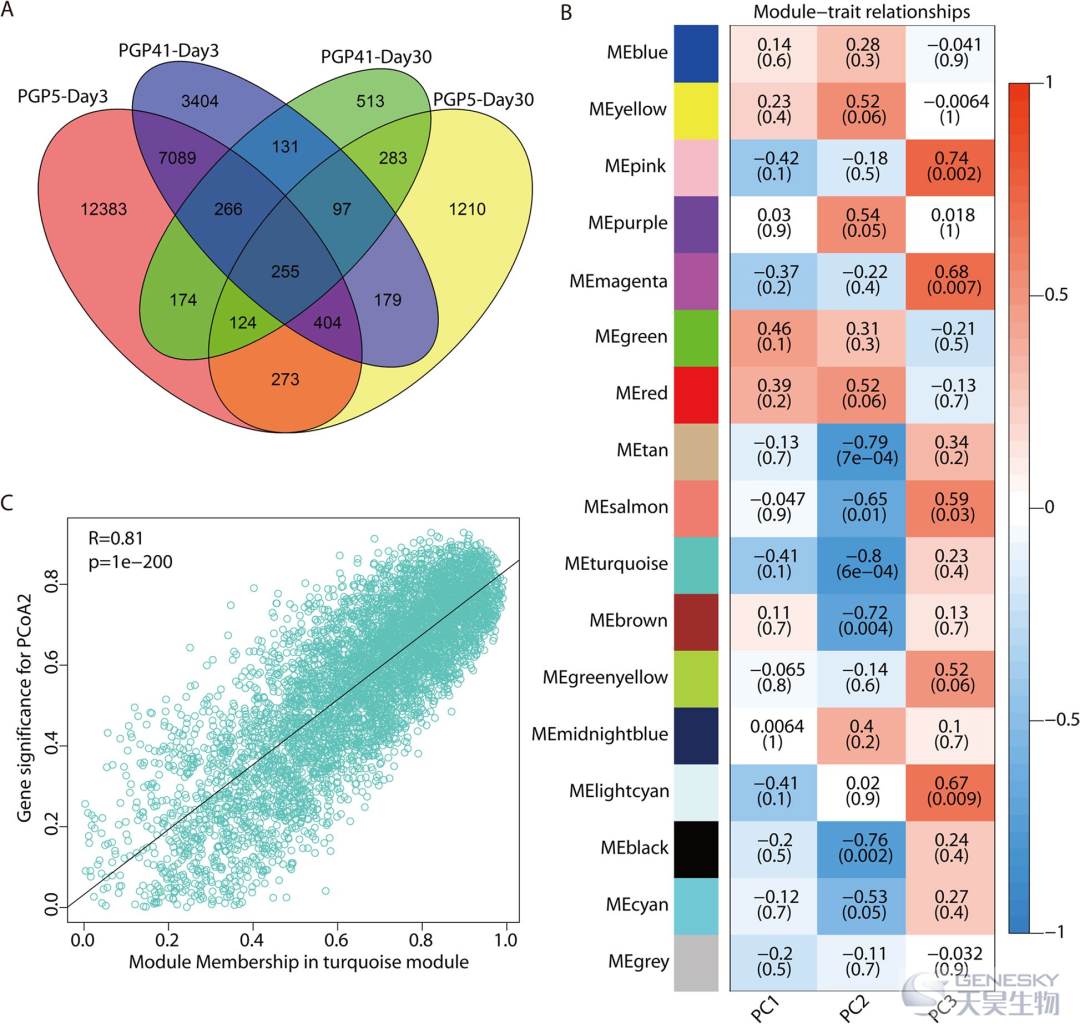
图4、根际微生物诱导的根中基因表达谱的变化。A)早期和晚期接种样品中 DEG的维恩图。B)WGCNA 显示模块特征基因 (ME) 与图1 G 中由 PCoA1-3 表示的根际微生物组的性状之间存在显着相关性。C)最显著模块(turquoise 模块)中基因显著性 (GS) 与模块成员(MM)间的散点图,相关系数为 0.81。
为了检测接种是否影响根中的 DNA 甲基化,进行了 DNA 甲基化的 WGBS 分析(图5)。结果表明,在植物-微生物相互作用期间,某些区域的 DNA 甲基化变化从开始阶段到晚期阶段都保持不变。DMR 类型与转录本丰度之间的关系表明,接种诱导的 DNA 甲基化修饰可能参与基因表达的调控。
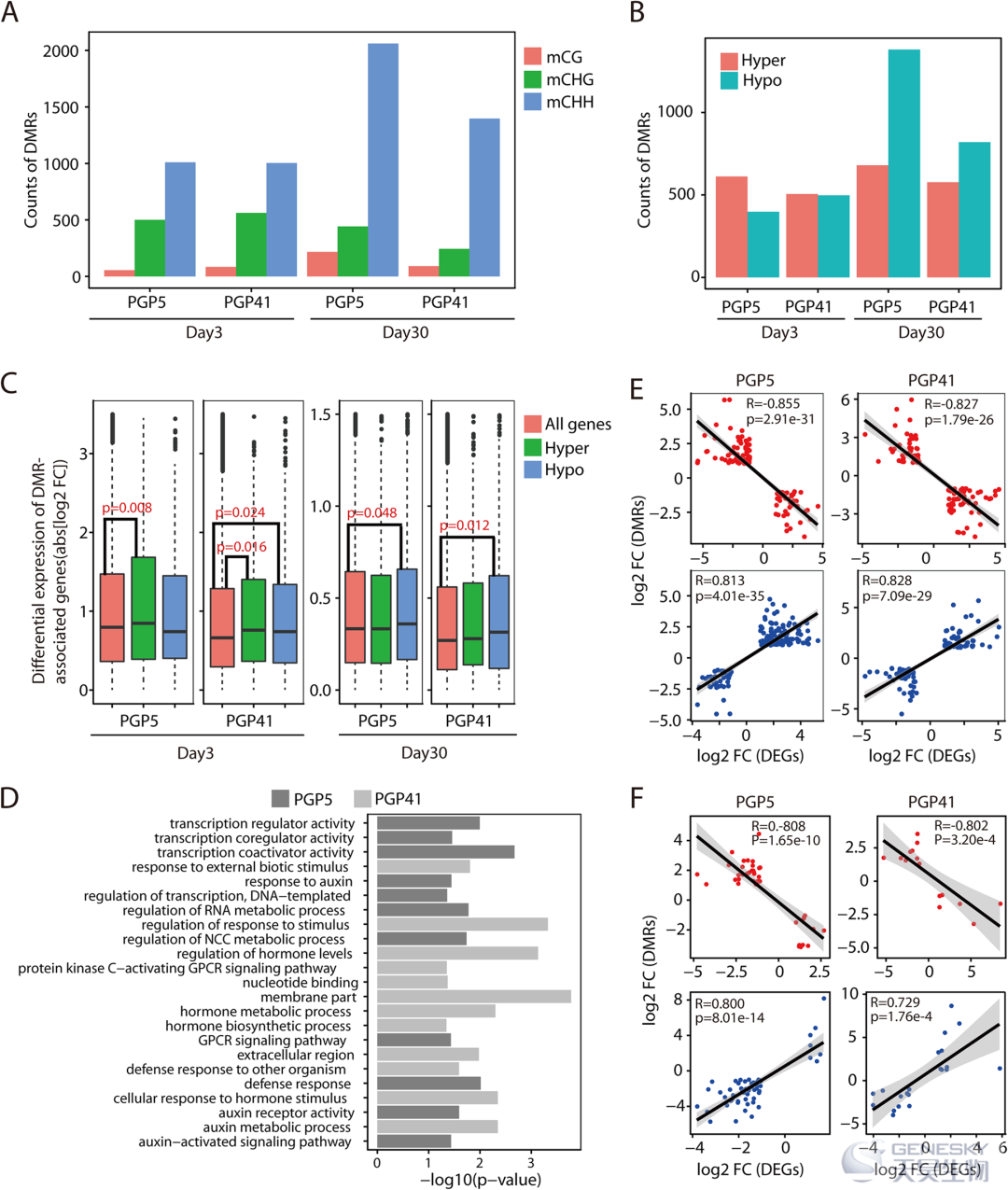
图5、DNA甲基化图谱变化和与基因表达的相关性。A)检测到的 DMR 数量。B)在不同样品中检测到的高甲基化或低甲基化 DMR 的数量。C)所有基因(红色)和超(绿色)或低甲基化(蓝色)DMR 的差异表达水平。D)GO 富集分析。NCC,含核碱基化合物;GPCR,G 蛋白偶联受体。E, F)DNA 甲基化(Y轴)变化与基因转录本丰度变化(X轴)在第 3 天(E)和第 30 天(F)重叠的 DEG 和 DMR 的散点图。重叠基因分为两组,分别显示正负关系。并且负相关和正相关分别以红色和蓝色显示。
我们进一步检测了 DMR 对基因表达的影响。首先,我们基于重叠的 DEG 和 DMR 分析了基因表达改变与 DNA 甲基化水平之间的相关性。在第 3 天和第 30 天,在基因表达的倍数变化和 DNA 甲基化之间检测到强烈的正或负关系(图5E,F)。此外,晚期 DMR 的 GO 分析揭示了参与调节转录、调节激素水平、防御反应、核苷酸结合和 G 蛋白偶联受体信号通路的基因富集(图5D)。所有这些功能都与基因表达调控有关。总之,这些数据表明基因转录至少部分地受到菌株 PGP5/PGP41 和植物之间相互作用中的 DNA 甲基化的控制。
DNA甲基化的变化与接种诱导的美洲商陆生长促进有关
通过定量PCR(qPCR)对16S rRNA基因的拷贝数进行定量,计算根际土壤和根中接种菌株的丰度。接种在早期阶段(第3天和第7天)显着增加了根际土壤中菌株PGP5和PGP41的丰度,并且两种接种物在对照土壤中的丰度迅速下降到相同的水平。对于菌株 PGP5 或 PGP41,与对照(未接种的根)相比,在接种的根中未检测到显着差异。结果表明,两种接种物早期都存在于根际土壤中,后期从根际土壤中清除,没有接种物在根部定殖。结果表明,根际微生物的变化和根中接种物的定殖都不是促进植物生长所必需的。
我们用Zeb处理了商陆的幼苗,来研究 DNA 甲基化在接种诱导的商陆生长促进中的作用(图6)。与未经 Zeb 处理的植物相比,这些基因在 Zeb 处理的根中显示出基因表达的错误调节,表明 Zeb 处理破坏了接种诱导的 DNA 甲基化模式植物。
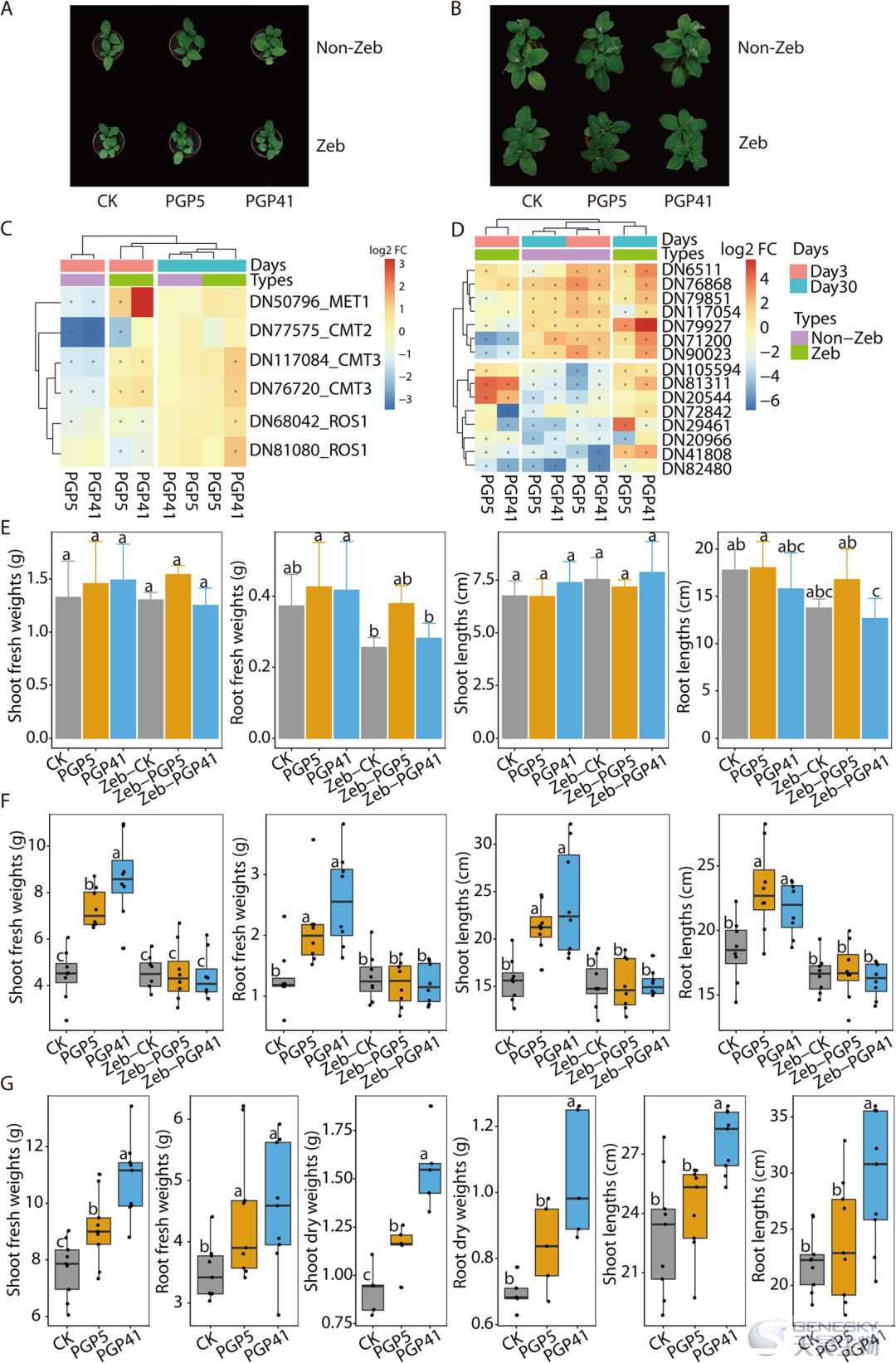
图6、用 DNA 甲基化抑制剂处理会破坏接种了PGP41 和 PGP5 菌株诱导的美洲商陆的生长。A, B)第 3 天 ( A ) 和第 30 天 ( B )进行处理的美洲商陆结果。C, D) 比较处理样品与对照样品中DEG 和 DMR的热图。Zeb 处理导致根中这些基因表达的错误调节。E-G)接种诱导商陆生长的比较。
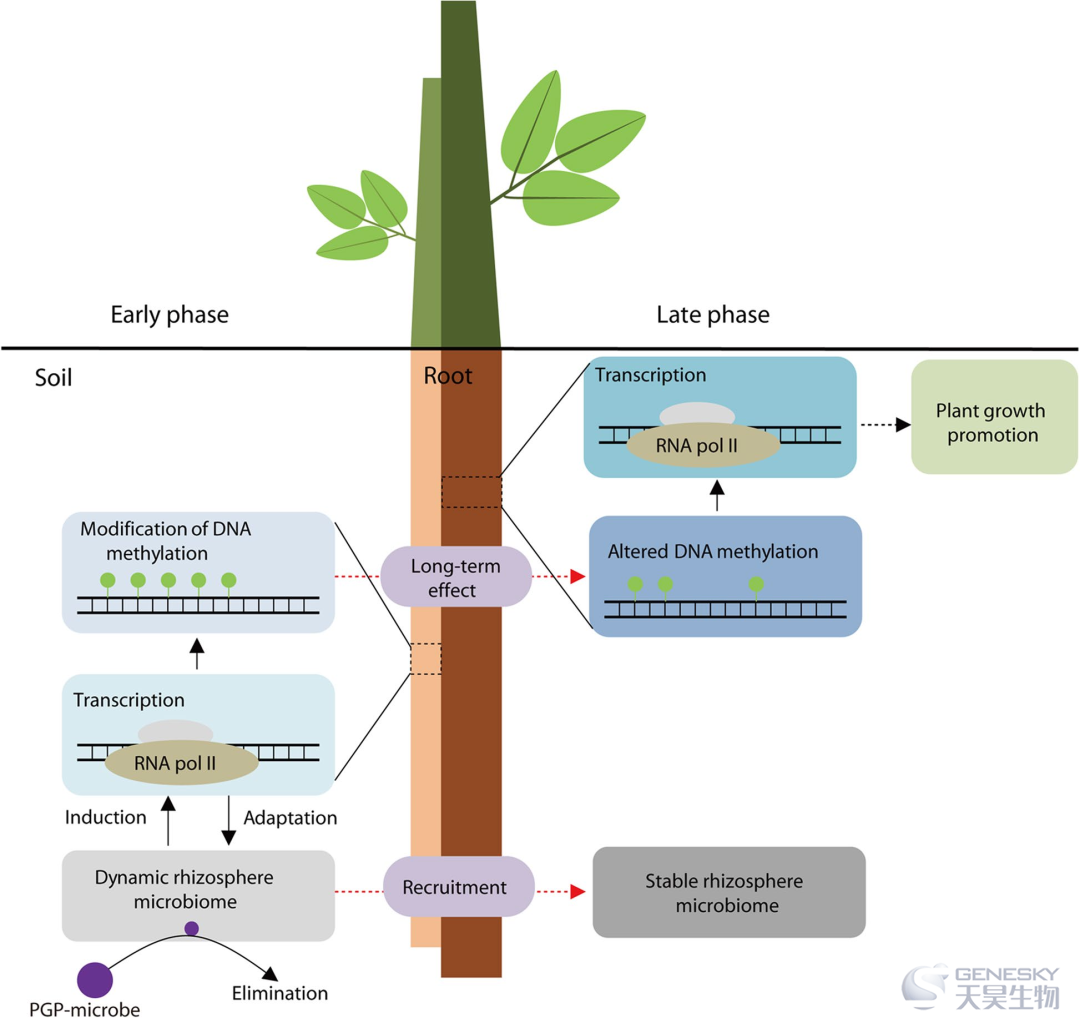
图7、PGPB 与植物之间由 DNA 甲基化和根系募集介导的两步相互作用的示意图。紫色圆圈表示 PGPB 接种物。绿色圆圈代表甲基化胞嘧啶。在早期阶段,接种 PGPB 会引起根际微生物组的变化。植物通过转录谱的全面变化来适应动态的根际微生物组,包括 DNA 甲基化相关基因,从而导致 DNA 甲基化的修饰变化。接种物对根际微生物组的影响随着根际微生物组中接种物的消除而减弱。在后期,改变的DNA甲基化可以来调控基因表达以促进植物生长,并通过根部组装出稳定的根际微生物组。
本研究为微生物-植物相互作用提供了新的见解,并强调了根中 DNA 甲基化修饰对 PGPB 的反应的重要性,提出了 PGPB 诱导的根中 DNA 甲基化修饰促进植物生长的新机制。此外,即使在从微生物组中消除接种物后,这些表观遗传修饰仍然有效。这些结果为微生物组操作提供了新的策略,以通过应用 PGPB 促进植物生长。在未来的研究中,应该更加深入研究早期 PGPB 诱导的 DNA 甲基化修饰的详细过程,以发现PGPB 产生的特殊分子/代谢物是否可以调控根系 DNA 甲基化水平。
咨询沟通请联系
18964693703(微信同号)

创新基因科技,成就科学梦想

 咨询热线:400-065-6886
咨询热线:400-065-6886

 咨询热线:400-065-6886
咨询热线:400-065-6886











