囊性纤维化呼吸道微生物组解析
英文题目:Insights into the respiratory tract microbiota of patients with cystic fibrosis during early Pseudomonas aeruginosa colonization
中文题目:对铜绿假单胞菌定植早期的囊性纤维化患者的呼吸道微生物组进行解析
期刊名:SpringerPlus 发表时间: 2015
研究背景: 慢性肺部感染是囊性纤维化(CF)发病率和死亡率的主要原因。CF患者的呼吸道在早期被许多细菌定植和感染,这些细菌包括铜绿假单胞菌、金黄色葡萄球菌、流感嗜血杆菌、洋葱伯克氏菌、氧化木糖无色杆菌,而铜绿假单胞菌是囊性纤维化(CF)最主要的病原体。有研究表明在CF孩子患者中,铜绿假单胞菌的定植与肺功能逐渐恶化有纵向相关性,因此在早期检测铜绿假单胞菌可以最大限度地有效控制这种病原体,而更好了解铜绿假单胞菌感染的初始步骤,将有助于防止它在CF病人呼吸道的早期定植。基于此,本文对CF患者铜绿假单胞菌定植初期的呼吸道微生物群落结构与动态变化通过焦磷酸测序进行了解析。
材料:5个囊性纤维化患者(CF),其年龄范围是5–19岁,随访周期是16–39 个月(平均22个月),共计收集到20个痰样本(每个病人平均4个样本)。痰标本质量通过新鲜涂片细胞学检查进行了验证。所有的样品根据标准对铜绿假单胞菌感染状态进行了鉴定,并分为两组:3个病人被定义为‘free’ (至少在前一年没有铜绿假单胞菌定植);2个病人被定义为‘never’(在痰或咳嗽拭子中从没有检测到铜绿假单胞菌定植)。所有患者在后续随访中均是铜绿假单胞菌阳性。
技术:16S rRNA扩增子测序(V3-V4);
测序平台:Roche 454 FLX 测序平台
研究结果:
呼吸道微生物多样性
结果发现样本细菌多样性非常高,平均Shannon指数达到3.58,这与其它相关研究得到的结果相符;Good's coverage指数(0.999)表明发现了大部分的细菌种类;每个样品的Chao-1菌群丰度指数仅比实际观察到的OTUs数目稍高,这表明真实菌群丰度没有被低估。推测本研究发现高细菌多样性是因为这些病人的年龄均非常年轻(平均10岁),据报道这个年龄段的细菌多样性是最高的。
CF患者核心肺部菌群
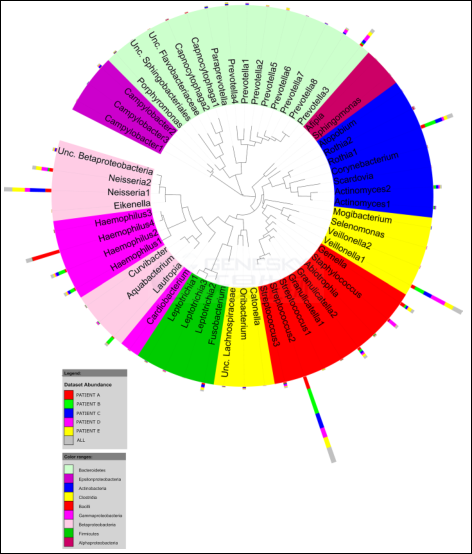
共计58个OTUs构成了CF患者核心菌群。如图1所示,鉴定到5个门: 厚壁菌门,变形菌门、放线菌门、拟杆菌门和梭杆菌门。这个核心CF肺菌群是由13个主要属构成 (相对丰度 >1 %) ,它们的总量达到核心reads的94 % 。实际上本研究发现的这13个CF核心肺部菌树在所有CF患者呼吸道微生物相关研究中都被发现过,其中9个菌属还是健康人肺部丰度最高的菌属。与以前的研究相符,本研究也发现了丰度较高的厌氧菌(如韦永氏球菌属和普氏菌)和兼性厌氧菌(如麻疹),而这两类菌被认为是CF病人肺部恶化的生物标记物。
研究还发现属于相关口腔微生物的细菌(例如TM6, TM7 , WPS-2)也低丰度地存在于痰样本中,虽然TM6和WPS-2已经被报道存在于痰样本中,但是TM7却是第一次被发现存在于痰样本中。而在CF儿童的痰样本中发现这类口腔微生物从侧面也证实了一个观点:口腔是潜在病原体的来源,例如厌氧菌,它能到达并定植在CF患者的下呼吸道。
图1: (CF)病人核心肺部菌群的细菌多样性系统发育树。内环不同颜色代表来自5个不同的门;每个节点代表一个核心OTUs(在50%的样品都存在的菌群,并且相对丰度大于总细菌群落的0.1%);外面的柱状代表5个CF病人每个OTUs的相对丰度。
铜绿假单胞菌定植早期的CF患者呼吸道菌群动态变化
如图2A所描绘的 ,在铜绿假单胞菌定植早期CF患者呼吸道菌群在生物量上虽然有波动,但是每个个体的菌群结构还是相对稳定的,可以明显分为五组。
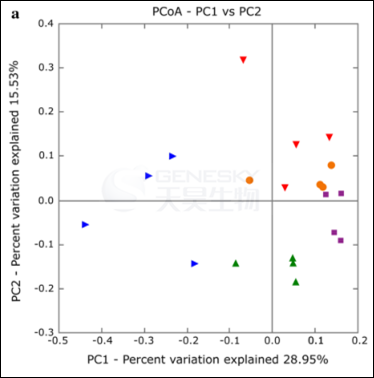
图2A:5个CF患者菌群结构的PCoA分析(患者A, 红色倒三角; 患者B, 蓝三角; 患者C, 橙色圈; 患者D, 绿色三角; 患者E,紫色方块)。
厌氧菌存在的持续性
随着铜绿假单胞菌早期定植过程的进行,发现9个OTUs以较高的丰度持续存在于所有样本中,这其中包括六个属,包括3个专性厌氧菌(韦荣球菌属、放线菌属和普雷沃菌属),和3个兼性厌氧菌(流感嗜血杆菌属,颗粒链菌属和链球菌属)(图 3),这说明厌氧菌在CF患者的病理生理学中发挥了重要作用,这是因为它们参与炎症,感染和肺功能。
本研究关注的一个问题是到底是铜绿假单胞菌的植入随后引起了厌氧菌的增殖还是反过来厌氧菌的增殖引起了铜绿假单胞菌的定植。在最初的“never”组(在痰或咳嗽拭子中从没有检测到铜绿假单胞菌定植)所有样本中都检测到相同的厌氧菌属,几个月以后这些人都感染了铜绿假单胞菌,这表明厌氧菌并不阻碍铜绿假单胞菌的植入。事实上,许多测序结果显示,常见的肺部疾病除了一些众所周知的肺部病原微生物,还存在一类核心菌群,它包括4个持续存在的厌氧菌属(韦荣球菌属、链球菌属、放线菌、普雷沃菌属),这表明存在一种“近墨者黑”的现象,即最主要病原菌对于铜绿假单胞菌群的植入起决定性作用,然而这四个菌属作为铜绿假单胞菌植入促进剂的作用仍有待明确。
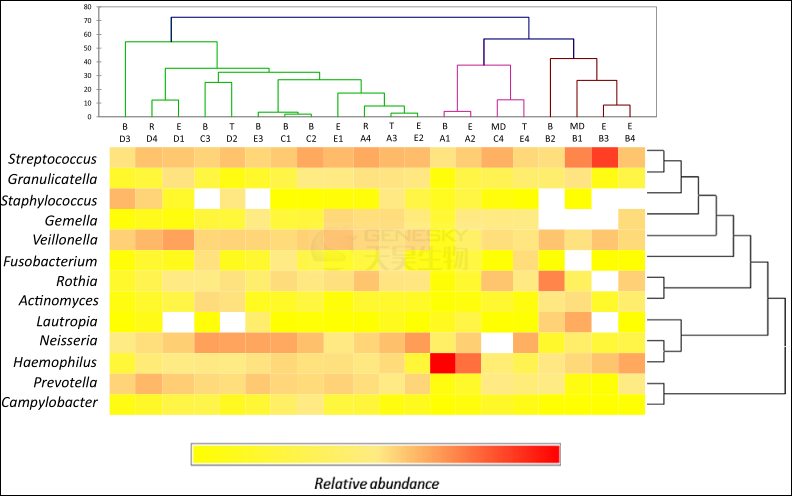
图3:CF患者痰样本13主要菌属的聚类分析。每个临床状态被注明 (B:基线临床状态; E:肺加重; T:治疗发作期; R:恢复期; MD:数据缺失;每一个菌属的相对丰度用红色(高丰度)或者黄色、亮白色(低丰度)标注。
微生物结构与铜绿假单胞菌感染状态相关
接着通过比较“never”组(在痰或咳嗽拭子中从没有检测到铜绿假单胞菌定植)和“free”组(至少在前一年没有铜绿假单胞菌定植) CF病人菌群来判断铜绿假单胞菌是否影响呼吸道菌群结构。首先发现两组病人间细菌密度和铜绿假单胞菌reads数目没有差异,接着发现这两组CF病人间的菌群多样性指数(Shannon)和菌群均匀度也没有差异,然而菌群丰度在两组CF病人间存在差异:“never”组病人的菌群丰度[Chao-1: 79.8 (72.03–87.61); 实际观察到的菌种数目: 71.6 (63.85–79.43)]要比“free”组病人[Chao-1: 62.7 (52–73.5);实际观察到菌种数目:55.9 (45.24–66.71)]的菌群丰度更高,因此CF病人呼吸道菌群丰度直接受铜绿假单胞菌首次植入的负调控。另外,如图2B和图S3所示,CF病人呼吸道菌群结构受铜绿假单胞菌不同感染状态的影响。
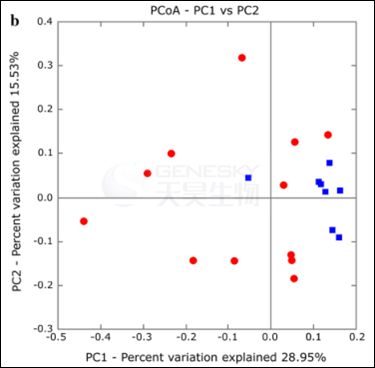
图2B:“never”组(红色圆圈)和“free”组(蓝色方块)CF病人菌群结构PCoA分析。
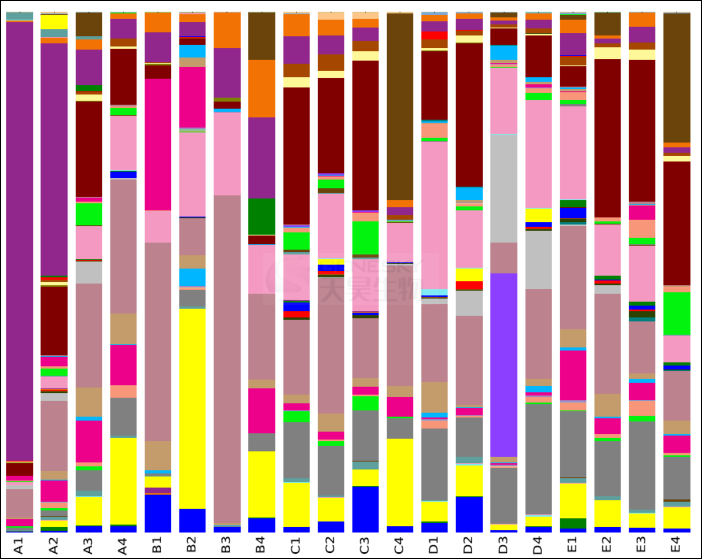
图S3:CF病人肺部微生物组属水平上的分类柱状图。
结果总结:
-
CF病人的呼吸道微生物群落结构表现出很高的多样性,并且这与CF病人的较小年龄相关。
-
鉴定到一个核心CF肺部菌群,它是由来自于5个门的13个主要菌属构成的,其中大多数是专性厌氧菌。
-
个体间和个体内的菌群结构有明显的变化。
-
CF病人呼吸道菌群丰度直接受铜绿假单胞菌首次植入的负调控。
-
无论铜绿假单胞菌感染状态如何一类厌氧菌群都持续存在,这表明它们在CF患者肺部的感染病理生理学中发挥着重要作用,因此某些菌属可能是肺部感染时期的潜在生物标志物。

 咨询热线:400-065-6886
咨询热线:400-065-6886

 咨询热线:400-065-6886
咨询热线:400-065-6886