
 咨询热线:400-065-6886
咨询热线:400-065-6886

 咨询热线:400-065-6886
咨询热线:400-065-6886
10x单细胞转录组测序
全转录组测序
常规mRNA测序
常规lncRNA测序
常规circRNA测序
常规miRNA测序
微量mRNA测序
外泌体miRNA测序
RNA表达水平定量
circRNA验证
线性消化circRNA测序
全基因组甲基化测序
850K甲基化芯片检测
多重目的区域甲基化富集测序
m6A修饰整体水平定量
m6A RNA甲基化测序
m6A修饰表达水平定量
染色质开放性测序(ATAC-seq)
肿瘤全基因组测序
肿瘤全外显子组测序
肿瘤目的区域捕获测序
肿瘤泛癌种基因panel突变检测
多重目的区域甲基化富集测序
肿瘤微卫星不稳定性分析
肿瘤TCGA等数据库个性化生信挖掘
Accu16S®细菌绝对定量测序
AccuITSTM真菌绝对定量测序
常规微生物16S/18S/ITS扩增子测序
微生物功能基因扩增子测序
宏基因组测序
线粒体/叶绿体基因组测序
SSRseq®超高通量SSR分型技术
动植物目标区域测序
动植物单细胞转录组测序
动植物目的区域甲基化富集测序
Taqman SNP分型
RFLP SNP分型(mf-RFLP)
Mulitiplex Snapshot多重SNP分型
iMLDR®多重SNP分型技术
SNPscan®高通量SNP分型技术
SNPseq®超高通量SNP分型技术
SNaPshot AEI分析
GWAS芯片服务
定量PCR检测拷贝数
MLPA试剂盒检测
AccuCopy®多重DNA拷贝数检测技术
CNVplex®高通量DNA拷贝数检测技术
CNVseq®超高通量DNA拷贝数检测技术
低深度全基因组测序
人线粒体拷贝数qPCR检测
STR细胞株鉴定
候选区域排查(致病基因排查)
单基因疾病家系定位
微卫星杂合性缺失分析(LOH)
微卫星不稳定分析(MSI)
Sanger测序基因突变位点检测
Sanger测序未知序列拼接
BSP直接测序
Elisa检测
人染色体端粒长度检测
生物信息学个性化分析
非靶向代谢组
靶向代谢组
试剂与产品
原创 上海天昊生物




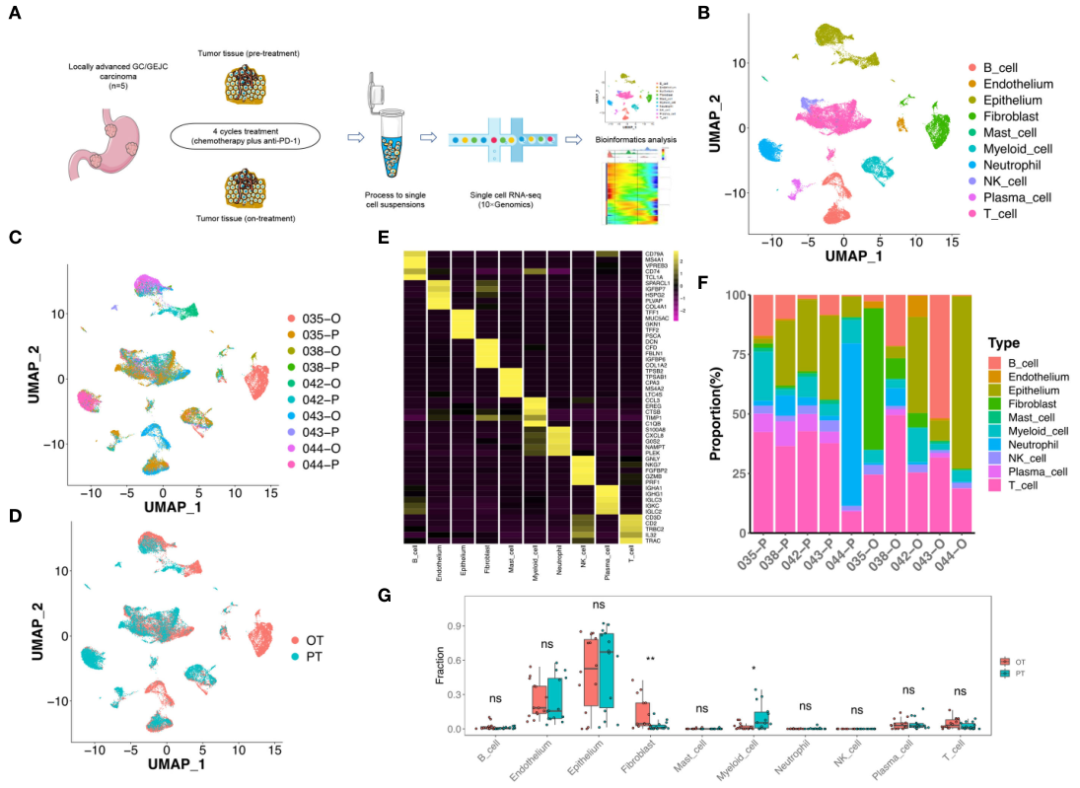
图1 联合治疗期间GC微环境的scRNA-seq分析
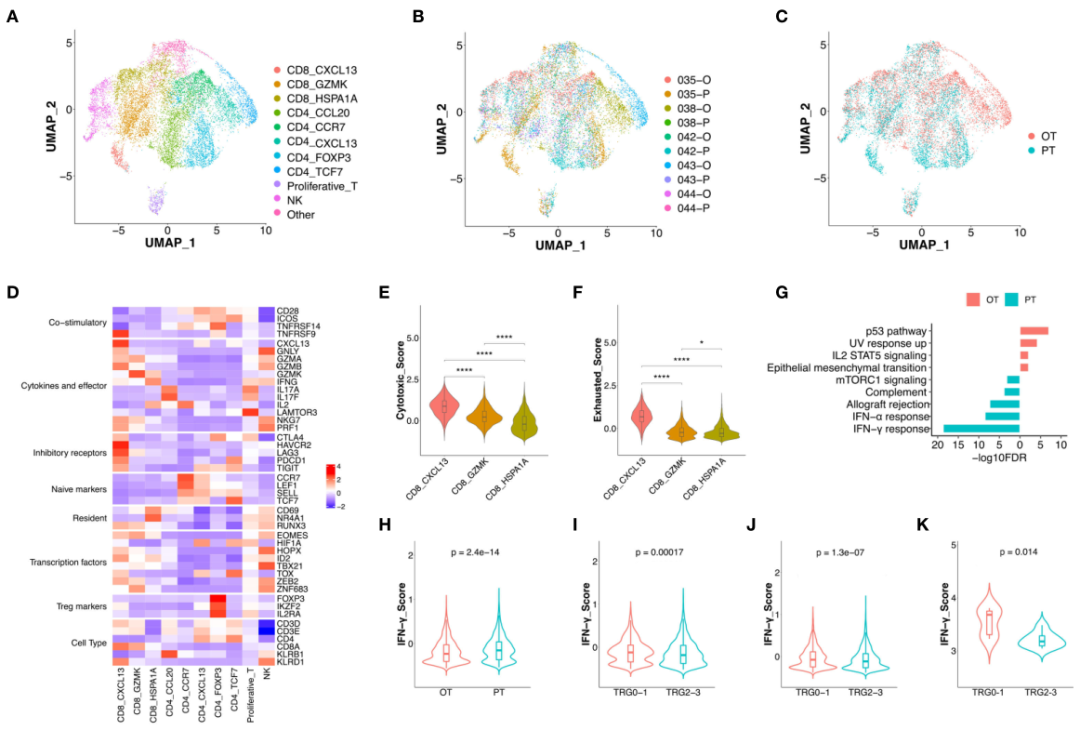
图2 治疗过程中CD8+ T细胞表达特征的变化
为了揭示PT和OT样本中CD8+ T细胞的动态功能变化,利用Monocle 2算法对CD8+ T细胞进行拟时序分析(图3A)。结果显示该轨迹路径始于CD8 CXCL13细胞,其次是CD8 GZMK细胞,最后是CD8 HSPA1A细胞(图3B)。沿着轨迹CD8+ T细胞的耗竭特征明显减少,而细胞毒性特征尽管最终减少,但相对于耗竭特征具有更高分数(图3C, D)。事实上,PT样本中CD8+ T细胞的细胞毒性和耗竭评分明显高于OT样本(图3E, F)。这些数据表明治疗期间CD8+ T细胞的变化在拟时和真实时间进程中是一致的。另外对CD8+ T细胞与轨迹相关的转录变化进行分析,发现CD8+ T细胞的三簇可分为3个阶段,并具有不同的信号通路富集(图3G)。
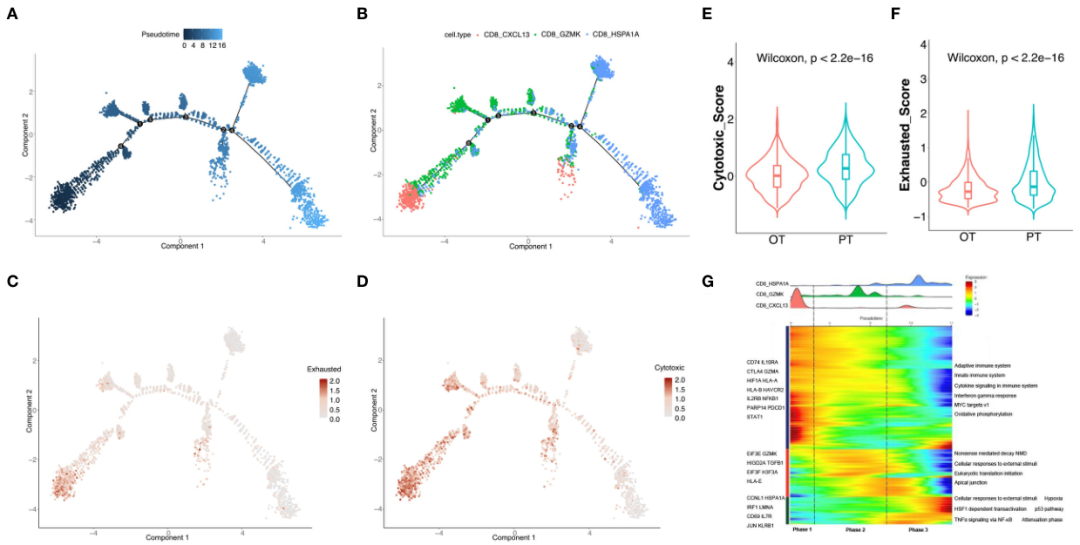
图3 轨迹分析揭示了CD8+ T细胞在治疗过程中的动态变化
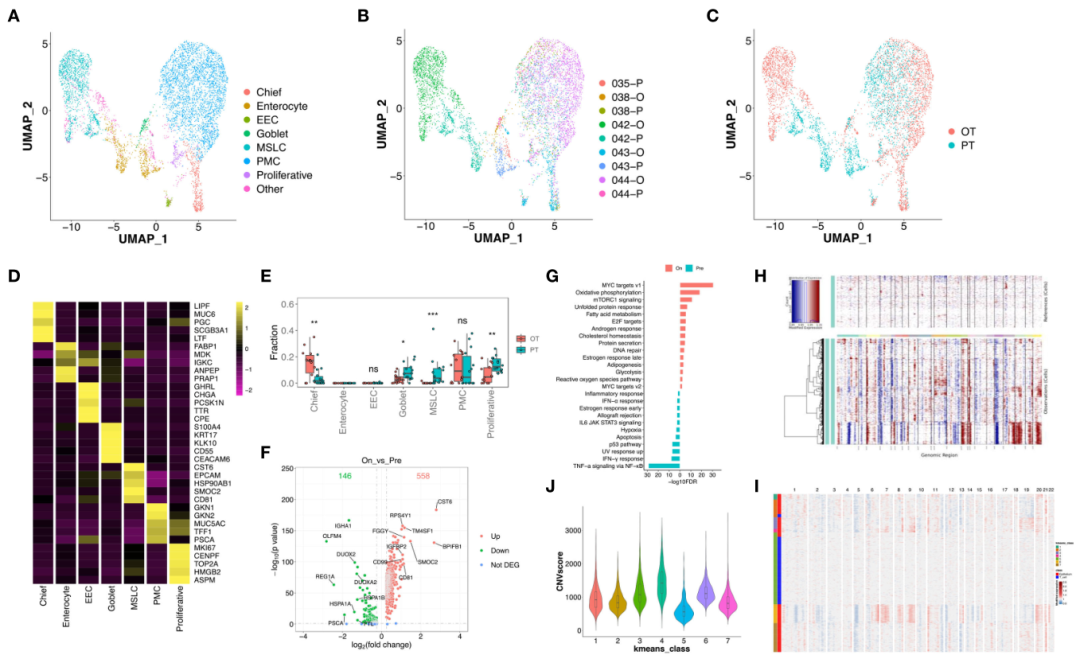
癌症相关成纤维细胞(CAFs,n = 4299)在重新聚类分析中显示出两种不同的亚群(图5A)。OT样本中出现的一群高表达CFD、DPT和各种趋化因子(包括CXCL12和CXCL14,图5B),这一特征与胰腺癌中描述的炎性CAFs (iCAFs)相似。分布在PT和OT样本之间的亚群具有RGS5和ACTA2的高表达,这与肌成纤维细胞CAFs (myCAFs)相似(图5B)。这些结果表明GC中的CAF具有与其他癌症相似的亚群。CIBERSORTx分析也证实,OT样本中的iCAFs显著增加,而myCAFs在PT和OT样本中没有明显变化(图5C)。我们的分析还发现了myCAFs和iCAFs中大量的差异表达基因(图5D)。myCAFs中RGS5和ACTA2表达上调与TCGA和GEO数据集中GC患者的总生存期较差相关(图5E)。
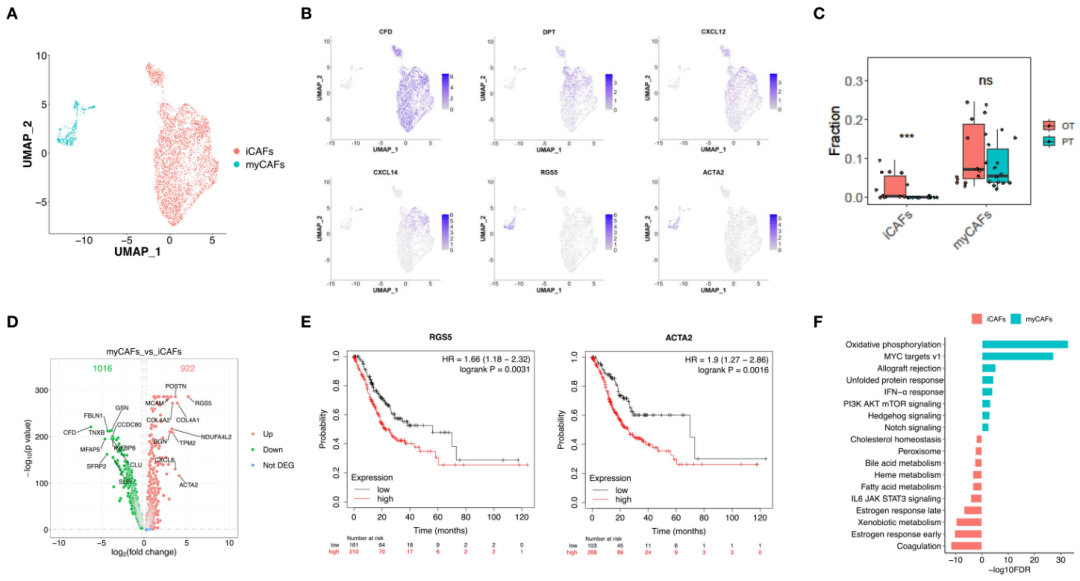
图5 两种不同的CAFs亚型在GC生态系统中表现出转录差异
此外,我们发现巨噬细胞与CD8+ T细胞之间的通讯增加(图7C, D)。值得注意的是,在PT和OT样本中,ANXA1- FPR1/2/3和ICAM蛋白广泛表达,并介导了巨噬细胞与CD8+ T细胞之间的相互作用(图7C, D)。这些结果表明,抗炎和细胞间粘附的相互作用在治疗过程中保持稳定。
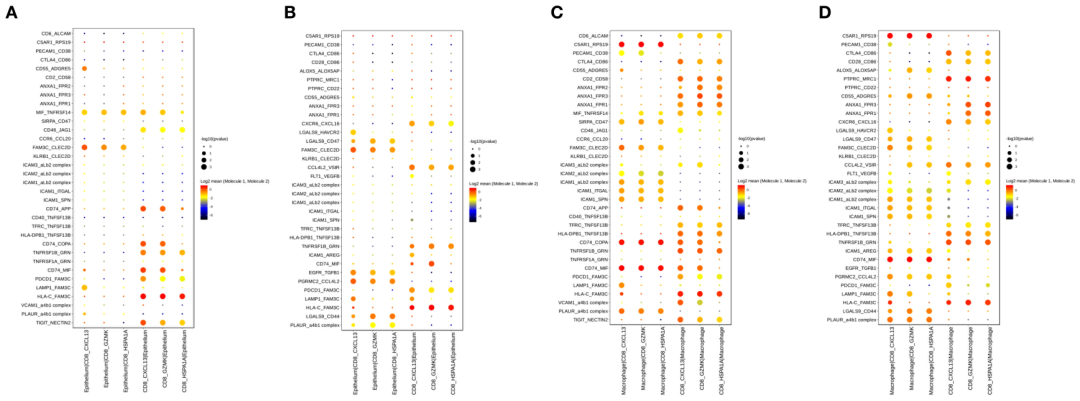
图6 联合治疗过程中CD8+ T细胞与上皮/巨噬细胞的细胞间相互作用


官方网址:http://www.geneskybiotech.com/