Gut:SNP介导m6A修饰影响基因表达和肿瘤进展
2020年4月m6A RNA甲基化方向IF > 10共有12篇文章:
Nature Genetics最新文章发现5种棉属异源多倍体物种的基因组多样性及其对棉花改良的影响。多倍体是许多动物和所有开花植物的进化创新,但它对选择和驯化的影响仍然难以捉摸。这项研究分析了所有5种异源多倍体棉花物种的基因组进化和多样性,包括具有重要经济价值的高地(Upland)和皮马(Pima)棉。虽然这些多倍体基因组在基因含量和同线性上是保守的,但通过亚基因组转座子交换平衡基因组大小、进化率的异源性及谱系内和谱系间同种生物间的正选择,它们已经多样化。这些不同的进化轨迹伴随着多倍体谱系间的基因家族多样化和同源表达差异。选择和驯化驱动两种栽培棉纤维中基因表达的相似性,包括共表达网络和N6-甲基腺嘌呤RNA修饰(文章中涉及m6A的相关内容:纤维中m6A修饰的mRNA和转录组数据都靶向参与翻译、水解酶活性和GTPase结合活性相关的基因。这些结果表明,当纤维细胞的细胞周期停止时,mRNA的稳定性和翻译活性可能决定纤维的伸长和纤维素的生物合成)。此外,多倍体诱导重组抑制,这与改变的表观遗传图谱相关,可以通过野生的基因渗入来克服。这些基因组学的见解将有助于控制基因重组及调整表观遗传修饰图谱和作物改良的目标基因。
防护有害病原体依赖于免疫系统的激活,而这一过程依赖于对基因表达的严格调控。最近,人们发现RNA修饰N6-甲基腺嘌呤(m6A)在这种调节中起着重要的作用。这篇最新的综述系统地总结了m6A在控制免疫的各个方面的新发现的功能,包括免疫识别,先天和适应性免疫反应的激活,以及细胞命运的决定。然后,详细讨论了该领域目前面临的一些挑战,并描述了揭示m6A的免疫功能及其作用机制的未来方向。
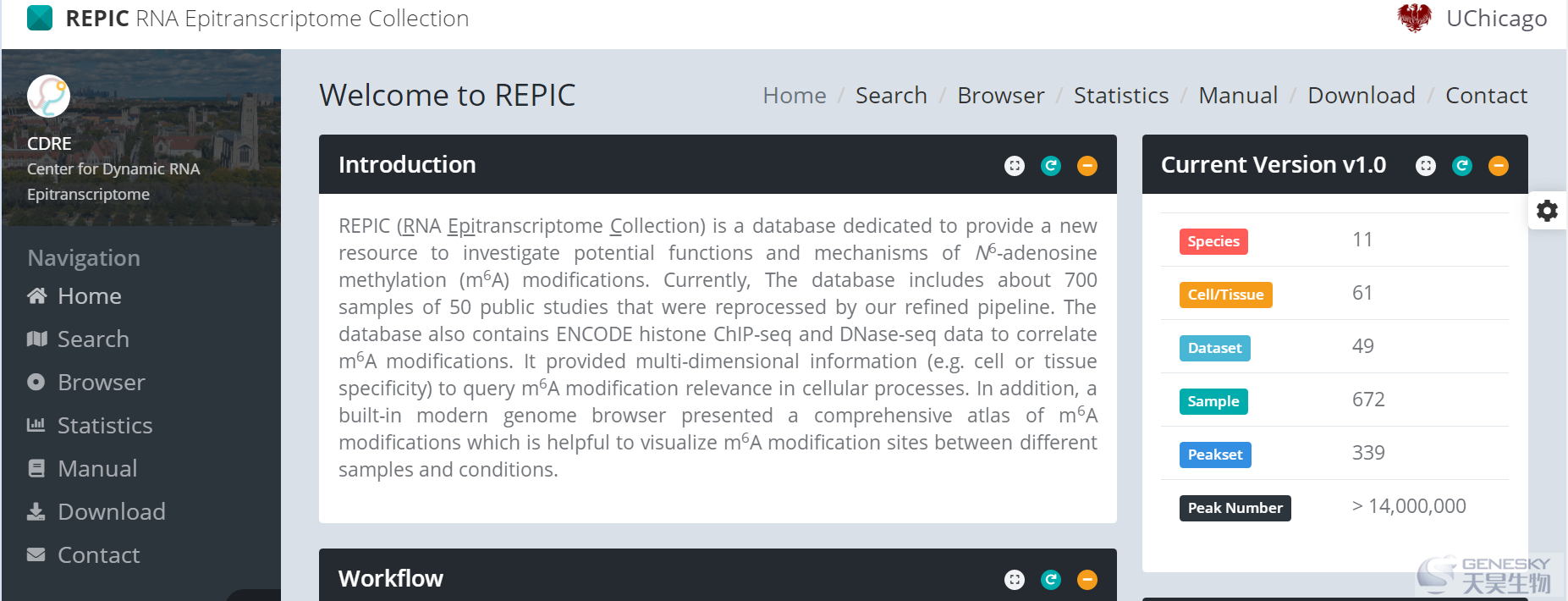
Genome Biology介绍了芝加哥大学团队开发的一款最新的m6A相关数据库REPIC:REPIC (RNA EPItranscriptome Collection,RNA表观转录组收集)数据库利用统一的流程记录了从公共可获取的m6A-seq和MeRIP-seq数据中调用的大约1000万个peaks。这些数据来自49项研究的672个样本,覆盖了11个物种的61个细胞系或组织。REPIC允许用户通过特定的细胞系或组织类型查询m6A修饰位点。此外,它将m6A/MeRIP-seq数据与ENCODE项目中的1418个组蛋白ChIP-seq和118项DNase-seq数据tracks整合进一个基因组浏览器,以呈现m6A甲基化位点、组蛋白修饰位点和染色质可及区域的综合图谱。可以通过
https://repicmod.uchicago.edu/repic访问REPIC。
基因表达受mRNAs的合成和降解速率的调控,但这些过程是如何协调的,我们知之甚少。这项研究证明了特定基因转录动力学的降低导致了m6A沉积的增强、CCR4-Not复合物的优先活性、poly(A)尾巴的缩短以及各自mRNA稳定性的降低。这些影响也由内部核糖体进入位点(IRES)元件发挥,其被认为是转录暂停位点。然而,当转录动力学,以及随后的poly(A)尾巴被整体改变时,细胞通过调节mRNA降解机制的表达来缓冲mRNA水平。应激引起的转录延长的整体障碍导致mRNA降解机制的显著抑制和大量mRNA的稳定。因此,整体转录增强,如接下来的B细胞激活或葡萄糖刺激,具有相反的效果。本研究揭示了通过将转录与mRNA的稳定性联系起来来维持哺乳动物细胞中基因表达平衡的两条分子通路。
Journal of Hepatology最新综述总结了表观转录组在肝脏疾病中的进展:新一代测序技术的发展和靶向化学修饰核苷酸的特异性抗体的发现,为一个新的表观转录组学时代铺平了道路。细胞RNA在转录后是已知的动态可逆地接受不同的化学修饰,如m6A、m1A、m6Am、m5C和hm5C,其身份和位置构成了表观转录组领域。动态转录后修饰通过调控靶RNA加工的各个方面来决定其命运,包括RNA转运、转录加工、剪接和降解。真核细胞中最丰富的mRNA内部修饰是m6A,它在胚胎发生、癌变、神经发生等生理过程中发挥重要作用。m6A由m6A甲基转移酶复合物(METTL3/14/16、WTAP、KIAA1429、RBM15/15B组成)写入,被去甲基化酶(FTO、ALKBH5)擦除,被结合蛋白(如YTHDF1/2/3、YTHDC1/2、IGF2BP1/2/3)识别。肝脏是最大的消化和代谢器官,m6A的修饰在肝脏的重要生理功能和各种肝脏疾病中发挥着独特的作用。本文就m6A RNA甲基化在脂质代谢、病毒性肝炎、非酒精性脂肪肝、肝癌、肿瘤转移等方面的生物学作用进行综述。此外,文章总结了现有的靶向m6A调节因子的抑制剂,并讨论了作为一种治疗策略,调节m6A修饰的潜力。

胰腺导管腺癌(PDAC)是世界上最致命的癌症之一。迄今为止,大多数药物都未能显著提高患者的存活率。m6A在PDAC的发生发展中起重要作用,但其在人类疾病中受种系变异驱动的异常调控机制尚不清楚。该研究首先对518例PDAC患者的总生存期进行了外显子范围的关联分析,并在包含552例PDAC患者的独立人群中进行了重复验证。随后,进行了一系列体内外生化实验,探讨候选变异及其靶基因PIK3CB在PDAC进展中的潜在机制。而且,PIK3CB选择性抑制剂KIN-193被用于阻断PDAC肿瘤生长。
在PIK3CB中发现了一种错义突变rs142933486与PDAC的总体生存显著相关的,其通过降低PIK3CB的m6A水平,并受m6A写蛋白复合物(METTL13/METTL14/WTAP)和m6A读蛋白YTHDF2调控PIK3CB mRNA和蛋白的表达水平。PIK3CB的上调广泛存在于PDAC肿瘤组织中,与PDAC的不良预后显著相关,尤其是在PTEN缺陷患者中。进一步证明了PIK3CB过表达显著增强了PTEN缺陷PDAC细胞的增殖和迁移能力,激活了AKT信号通路。值得注意的是,KIN-193作为一种PIK3CB选择性抑制剂,被证明是一种有效的抗癌剂,可阻断PTEN缺陷的PDAC。因此这些发现证实了异常的m6A稳态是PDAC的一种致癌机制,并强调了PIK3CB作为该疾病治疗靶点的潜力。


U6 snRNA 43位(m6A43)的N6-甲基腺嘌呤修饰是由METTL16催化的,在pre-mRNA剪接过程中,对U6 snRNA的5’剪接位点识别具有重要意义。人METTL16由N端甲基转移酶结构域(MTD)和C端脊椎动物保守区(VCR)组成。虽然MTD具有一种内在的特性,可以在RNA的不同结构环境中识别特定的序列,但是VCR的功能仍然没有被识别出来。这项研究对人体METTL16 VCR的结构和功能进行分析。VCR增强了METTL16对U6 snRNA的亲和力,VCR中保守的基本区对METTL16与U6 snRNA的相互作用具有重要意义。VCR结构在拓扑结构上与U6 snRNA特异性末端尿苷酸转移酶1 (TUT1)的C端RNA结合域KA1同源。METTL16的N端MTD和TUT1的C端KA1的嵌合体比MTD更有效地甲基化了U6 snRNA,这表明VCR和KA1在U6 snRNA的生物合成方面具有功能上的保守性。VCR与U6 snRNA的内部茎环(ISL)相互作用,这种相互作用将诱导U6 snRNA中包含A43的区域的构象重排,从而通过MTD修饰RNA结构,使其适合于生产催化。因此,METTL16中的MTD和VCR协同促进了m6A43 U6 snRNA的修饰。

背景:表观遗传改变参与结直肠癌发生的各个方面。RNA的m6A修饰是一种新兴的表观遗传调控分子。m6A是真核生物mRNA最丰富的化学修饰,是调节mRNA稳定性、剪切和翻译的关键。m6A调节基因的改变在多种人类疾病的发病机制中起着重要的作用。然而,这种mRNA修饰是否参与结直肠癌(CRC)的糖代谢尚不清楚。
方法:采用转录组测序和液相色谱-串联质谱法(LC-MS)评价CRC中m6A修饰与糖代谢的相关性。通过质谱代谢组学分析、体内外实验研究METTL3对CRC糖酵解和肿瘤发生的影响。采用RNA甲基化免疫沉淀测序、免疫沉淀、RNA稳定性实验探讨METTL3在CRC中的分子机制。
结果:徐州中心医院结直肠癌患者METTL3与18F-FDG摄取存在较强相关性。在多种CRC模型中,METTL3诱导的CRC肿瘤发生依赖于细胞糖酵解。机制上,METTL3直接与HK2的5’/3’UTR区、SLC2A1 (GLUT1)的3’UTR区相互作用,并进一步稳定这两个基因,激活糖酵解途径。m6A介导的HK2和SLC2A1 (GLUT1)的稳定性分别依赖于m6A识别蛋白IGF2BP2或IGF2BP2/3。
结论:METTL3是CRC的一种功能性和临床致癌基因。METTL3通过m6A-IGF2BP2/3依赖机制稳定CRC中HK2和SLC2A1 (GLUT1)的表达。靶向METTL3及其通路为高糖代谢的CRC患者提供了合理的治疗靶点。
RNA修饰可以通过催化必要反应的各种酶添加或移除,这些修饰在基本的分子机制中起作用。mRNA中普遍的修饰包括m6A、m1A、m5C、hm5C、假尿苷(Ψ)、肌苷(I)、尿苷(U)和核糖甲基化(2’-O-Me)。这些修饰主要参与真核细胞的pre-mRNA剪接、核运输、转录稳定性和翻译起始。通过参与各种生理过程,RNA修饰在肿瘤和非肿瘤疾病的发病机制中也具有调控作用。这篇综述讨论了RNA修饰的生理作用,并将这些作用与疾病的发病机制联系起来。RNA修饰作为转录和翻译之间的桥梁,对许多疾病的进展都至关重要,甚至可以调控癌细胞的命运。
m6A是真核RNAs中最常见的修饰。m6A的生物学重要性依赖于m6A识别蛋白,它控制着mRNA的命运和功能。然而,关于m6A识别蛋白的其他调节亚基是否参与了RNAs上m6A的识别仍有待探索。这项研究发现长链非编码RNA LINC00266-1编码了一个71氨基酸多肽。该多肽主要与RNA结合蛋白相互作用,包括m6A识别蛋白IGF2BP1,因此被命名为RNA结合调控多肽(RNA binding regulatory peptide, RBRP)。RBRP与IGF2BP1结合,增强IGF2BP1对c-Myc mRNA等RNAs的m6A识别,增加c-Myc mRNA的稳定性和表达,从而促进肿瘤的发生。具有RBRPhigh的癌症患者预后较差。因此,LINC00266-1编码的致癌多肽RBRP是m6A识别蛋白的一个调节亚基,通过m6A识别蛋白加强对目标RNAs的m6A识别,发挥其致癌功能。
来自浙江大学和北京大学的团队分别在Nature Chemical Biology杂志上背靠背发表了两篇文章介绍了m6A检测新的实验方法。
其中浙大团队基于一种代谢标签的方法能够从单碱基分辨率上对m6A修饰进行检测,该研究的测序方法特点如下:(1)利用代谢对甲基化位点的源头标记并直接单碱基分辨率测定,相对于当前的间接方法有更高的准确率;(2)适用于细胞内RNA多种不同甲基化基序(m6A motif)的鉴定;(3)对测定m6A簇修饰有优势。该方法为将来研究细胞核内种类繁多的新生RNA的m6A甲基化位点及状态演变提供了重要工具。另外,该方法在标记产率和标记时间窗口尺度方面还需要优化提高,为研究更多的细胞事件过程提供便利。
而北大团队不依赖于抗体,基于酶协助的化学标签方法进行m6A检测。该项研究首次利用FTO酶辅助实现了m6A化学标记,并成功应用于高通量测序。m6A-SEAL具有高灵敏度和高特异性的特点,可以应用于少量mRNA样品中。未来研究者们将继续对m6A-SEAL进行优化和改造,以实现单碱基分辨率。由于FTO可以氧化催化RNA的cap m6Am和DNA的N6-甲基脱氧腺嘌呤(6mA),未来m6A-SEAL通过优化有望应用于这些化学修饰的测序。同时该方法除了可以在m6A上标记biotin用于富集,还可以标记荧光素,未来用于m6A的成像。

 咨询热线:400-065-6886
咨询热线:400-065-6886

 咨询热线:400-065-6886
咨询热线:400-065-6886