英文题目:The microbiome and human cancer
几个世纪以来,微生物在癌症形成、诊断、预后和治疗中的作用一直存在争议。最近的研究却发现,细菌、病毒和/或真菌在癌症中无处不在,是癌症免疫治疗的关键因素,并且可用于治疗癌症转移。虽然有这些发现,但是已知直接导致癌症的微生物数量仍然很少。根据现代癌症生物学来批判性地评估和建立这些证据的框架是一项重要的任务。在这篇综述中,我们描述了微生物在癌症中的因果和辅助作用,并追踪了它们通过宿主免疫系统产生的影响,本文将其定义为免疫肿瘤学-微生物组轴(immuno-oncology-microbiome axis)。我们进一步回顾了肿瘤内微生物的证据,总结了操控宿主肠道或肿瘤微生物菌群的方法,并预测接下来可能的发现。
癌症和人类微生物菌群的历史紧密交织在一起。早在公元前1550年,埃及医生伊姆霍特普在《亚伯斯古医籍》中就提出了一种治疗肿瘤(肿胀)的粗略方法,即在伤口处敷上膏药,然后切开引起感染。在13世纪,佩雷格里恩·拉齐奥西描述了他的脓毒性、溃疡性胫骨恶性肿瘤的自发消退,为此他在1726年被封为圣徒。在传染病的细菌理论建立后,威廉·布施和弗里德里希·费莱森在19世纪晚期独立报道了化脓性链球菌感染与几个患者的自发性肿瘤消退有关。此后不久,癌症免疫治疗先驱威廉·科利开始在晚期癌症患者身上测试一种有高度争议的、有时是致命的活的或热致死的链球菌和沙雷氏菌种疫苗,后来才显示出在约30%的患者中产生> 10年的无病生存率(总共210例中的60例),这代表了免疫疗法的首次有意尝试。与此同时,托马斯·格洛弗和弗吉尼亚·利文斯顿-惠勒有争议地声称,细菌可以从肿瘤中培养出来,细菌疫苗对肿瘤有效,并提出了癌症的普遍细菌起源。这些早期的治疗方法和理论充满了错误:利文斯顿-惠勒的Progenitor cryptocides细菌是癌症“病因”,被证明是皮肤共生的表皮葡萄球菌Staphylococcus epidermidis(一种常见的污染物),格洛弗的发现不能被美国国立卫生研究院的研究人员重复。由于没有机械性的证据、不可再现的结果和危险的疗法,癌症的细菌理论被否定了。
1911年,裴顿·劳斯在鸡身上发现了一种可传播的致癌病毒后,癌症的病毒理论开始流行。随后长达数十年的寻找每一种癌症背后的病毒研究将疱疹病毒、人乳头瘤病毒和肝炎病毒与癌症发生联系起来,但未能找到一种可以导致大多数人类癌症的病毒,之后该理论被体细胞突变假说超越。
现在,经过人们对癌症数十年的深入研究,从以体细胞突变和宿主为中心的观点上,发展出新的理论见解,即微生物可能在癌症诊断、发病机制和治疗中发挥着广泛的作用。它重新评估了对生长在人体内的大量微生物(数量大致等于人类细胞),超过人类基因组基因数量约100倍的微生物基因的作用,及其产生的多样性代谢变化,和对宿主免疫系统发育和活性的影响(包括抗肿瘤免疫监控)。尽管大多数研究提出的癌症-微生物关系集中在肠道菌群,但最近的研究也通过结合成像、测序和培养技术,以及基因工程和无菌小鼠模型,揭示了肿瘤内微生物菌群的存在、代谢活性和功能重要性。这些研究提出了许多关于微生物和癌症的问题。根据已知的以宿主为中心的癌症特征,应该如何看待微生物?微生物在多大程度上造成癌症,是因果关系、共同影响还是被动影响?如果肿瘤微生物存在,它们有治疗意义吗?微生物在患者管理中扮演什么角色?考虑到这些问题,本综述旨在批判性地评估微生物在癌症中的已知作用,并概述评估其临床应用的后续步骤。
在地球上大约1012种不同的微生物物种中,只有11种被国际癌症登记协会(IACR)标记为人类致癌物,或称“oncomicrobes”。这些微生物每年导致约220万例病例(约占全球癌症病例的13%),其流行病学、分子机制和临床研究已得到广泛论述。强有力的实验证据表明,额外的微生物通过基因毒素介导的诱变引发癌症;特别是大肠杆菌素(一种DNA烷化剂),细胞致死性扩张毒素(CDT),以及脆弱拟杆菌毒素(Bft, 活性氧(ROS)产生者)导致在结肠直肠癌、头颈癌和泌尿道癌中发现的突变信号。实验证据还表明,一些具有毒力因子的微生物通过E-钙粘蛋白-Wnt-β-连环蛋白信号放大肿瘤发生,包括来自具核梭杆菌的FadA和来自几个沙门氏菌菌株的AvrA。根据目前的流行病学和实验证据,几十种微生物可以直接导致癌症。
越来越多的证据表明,一类重要的“共谋”微生物虽然不足以导致癌症,但也促进了癌症的发生。这一类包含生物活性代谢物的微生物菌群,在实体肿瘤的发生发展中可能具有作用。免疫系统很少引发早期病变,但可以通过肿瘤间质反馈回路、炎症或功能失调的免疫监视促进进展。一个例子是常见的p53突变仅在微生物产生没食子酸存在下是致癌的,而在肠道中是保护性的,无论是在体内还是在类器官中,这表明微生物-功能基因组相互作用。第二种是微生物产生的次级胆汁酸,它降低肝窦CXCL16的表达(CXCR6的唯一配体),并防止CXCR6+自然杀伤T细胞聚集和肝癌免疫监视——这种致癌作用会通过万古霉素治疗消除。第三个来自于Kras突变和p53缺失不能在无菌或抗生素治疗的小鼠中产生肺癌:共生肺微生物菌群促进γδ T细胞的扩张和活化,γδ T细胞通过局部白细胞介素-17 (IL-17)和IL-23释放驱动促肿瘤炎症。这些例子说明了微生物或微生物功能是如何与癌症共同作用而不是直接导致癌症的。
与少数真正的微生物相反,许多复杂的微生物及其功能是广泛而未被研究的。共生微生物需要介质来促进肿瘤的发展,局部或远距离调控肿瘤的进展和治疗效果。与已知的因果机制一起,这些“共谋”机制的多样性及其与以宿主为中心的癌症标志的关系值得注意(图1),但它们需要更严格的实验和跨队列验证来确定临床流行率和实用性。

微生物来源的代谢物、基因毒素和抗原影响宿主抗肿瘤免疫、炎症、能量学、细胞信号传导和转移。dsDNA,双链DNA;mAb,单克隆抗体;MDSC,髓源性抑制细胞;MMP,基质金属蛋白酶;NKT细胞,自然杀伤T细胞;SCFAs,短链脂肪酸。
了解微生物在全身的分布对于了解它们与癌症的关系非常重要。大约3 × 103种微生物物种的4 × 1013个微生物细胞栖息在人体内:这些细胞中约97%是结肠内的细菌,~ 2 ~ 3%是结肠外的细菌(近肠、皮肤、肺等)。还有~ 0.1%到1%是古细菌和真核生物(包括真菌)。感染人类的病毒和噬菌体的数量和多样性可能更大。结肠细菌的高密度被认为驱动了哺乳动物肠道中大多数已知的微生物免疫调节作用,肠道是体内最大的免疫器官,但器官特异性共栖可能发挥其自身压倒一切的影响。Nejman等人使用qPCR对16SrRNA进行定量来估计黑色素瘤、肺、卵巢、胶质母细胞瘤、胰腺、骨和乳腺癌组织切片中40 ng DNA的细菌数量。假设组织同质性和每个癌细胞8 pg的DNA(基于来自全基因组泛癌分析项目的2.36个平均肿瘤倍性),Nejman等人的数据表明平均泛癌百分比细菌组成为0.68%细菌,单个肿瘤的细胞计数范围从无细菌到接近70%细菌。将该百分比细菌组成应用于三维和平面环境相当于每1 cm3肿瘤约105至106个细菌或约34个细菌/mm2[假设5000个细胞/mm2],后者相当于最近泛癌队列中约21个细胞/mm2的平均PD1+ T淋巴细胞肿瘤核心密度。这些细菌组成估计仍有待在其他队列和癌症类型中得到证实,并用正交方法进行验证。此外,这些微生物分类群和功能中的哪一个能够影响宿主,尽管它们的丰度很低,仍然是未知的,在营养丰富和免疫抑制的空间中仅仅是乘客的比例也是未知的。
肠道微生物菌群可以调控肿瘤的微生物的许多功能,通常是通过免疫调控进行。已知的微生物机制可以控制肠道上皮屏障的非造血和造血成分,调节初级和次级淋巴器官活动,并调控肿瘤微环境(TME)的免疫。我们将这些免疫介导的相互作用和集体反馈回路定义为免疫肿瘤学-微生物组(IOM)轴(图2)。肠道-TME互作,特别是在非胃肠道癌症,仍然是一个关键的发现领域。
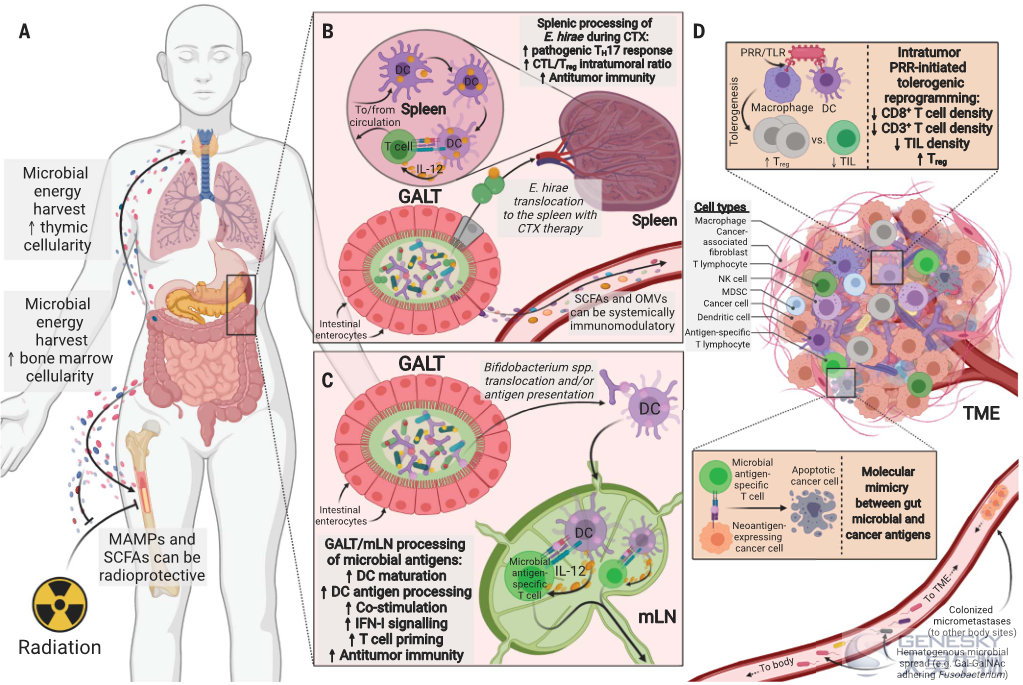
图2、免疫肿瘤学-微生物组轴(IOM)定义
肠道和TME微生物菌群调节宿主代谢和免疫,最终影响抗肿瘤免疫。(A)肠道微生物代谢产物和副产物影响宿主淋巴和骨髓生成,包括在异体HSCT和放疗期间。(B)环磷酰胺(CTX)——来源于肠道上皮的损伤使大肠杆菌易位和抗肿瘤免疫成为可能。(C)双歧杆菌属物种或其抗原的肠道易位可增加IFN-I信号传导和抗肿瘤免疫。TME的微生物可以是免疫抑制的(通常是PRR介导的)或免疫原性的,包括形成对免疫疗法的反应。癌症(neo)抗原可能通过分子模拟与微生物共享表位。微生物血源性扩散或定殖微转移可以完成这个起源于肠道的反馈回路。CTL,细胞毒性T淋巴细胞;DC,树突细胞;GALT,肠相关淋巴组织;MAMPs,微生物相关分子模式;mLN,肠系膜淋巴结;NK细胞,自然杀伤细胞;OMVs,细菌外膜小泡;SCFAs,短链脂肪酸;TIL,肿瘤浸润淋巴细胞。
异体造血干细胞移植(HSCT)后,强大的免疫重建可以有效控制患者复发和移植相关死亡率。最近的一项多中心、多国临床试验表明,异体HSCT移植后,较高的肠道微生物多样性与较低的患者死亡率显著相关。此外,在一项异体HSCT试验中,对超过10,000份纵向粪便样本的患者血细胞计数的每日变化差异进行了共同分析,免疫重建动态与肠道微生物菌群组成密切相关。在小鼠模型中也证明了肠道菌群、营养、移植后骨髓和胸腺细胞,以及淋巴和骨髓生成之间的联系。肠道微生物耗竭会损害骨髓移植后的全身感染清除,并使小鼠对半致死剂量的辐射敏感。微生物来源的化合物可以通过产生丙酸盐和色氨酸代谢物,或通过释放已知维持骨髓来源的骨髓细胞和中性粒细胞功能的微生物相关分子模式(MAMPs)来保护免受辐射诱导的造血损伤。这种效应可以部分解释为RIG-I的内源性配体(如3pRNA和来自病毒、噬菌体或细菌的RNA)的递送,其可以诱导肠细胞中的保护性I型干扰素(IFN-I)信号传导和肠屏障修复。移植后的淋巴生成也依赖于从饮食中获得的能量,并可能依赖于其基因组储备编码碳水化合物活性酶的菌属。
肠道菌群具有广泛的作用,在稳态和肿瘤发生过程中有助于宿主免疫调控。抗癌疗法已经证明了不同的共生体和保护性抗肿瘤T细胞反应之间的强联系:(i)环磷酰胺使希雷氏肠球菌能够转移和刺激致病辅助性T细胞17 (TH17)响应,以及使IFN产生CD8+ T细胞效应物,进而可以检查肉瘤和肺腺癌模型中肿瘤生长;(ii)在一些黑色素瘤患者中,细胞毒性T淋巴细胞相关抗原4 (CTLA-4)的阻断允许粪便中调控Toll样受体4 (TLR4)和IL-12依赖性TH1反应和治疗效果的多形拟杆菌和脆弱拟杆菌的相对富集;(iii)抑制程序性细胞死亡蛋白1和/或其配体[PD-(L)1]导致针对黑色素瘤的T细胞的启动效应,并且当宿主在其微生物组中含有双歧杆菌物种时更有效;(iv)全身照射后针对黑色素瘤的过继性T细胞转移功效取决于微生物菌群的组成、肠道细菌的易位和宿主TLR4信号传导;(v)奥沙利铂诱导的回肠细胞死亡反向控制回肠中免疫原性的韦荣球菌科和耐受性的梭杆菌科比例,指示结肠癌中抗肿瘤滤泡性T辅助细胞和有害TH17反应之间的平衡。
在大多数模型中,来自肠相关淋巴组织(GALT)、脾脏或肿瘤引流淋巴结(LN)的树突状细胞(DC)可以感知各种共生体(双歧杆菌、脆弱芽孢杆菌、粘蛋白拟杆菌、类杆菌、拟杆菌S24-7),通过IFN-I和IL-12介导的途径催化免疫反应。除了提供DC辅助物之外,肠道菌群代表了一种抗原来源,可以引发全身共生特异性T细胞反应。在同源自身抗原的情况下,这些共生特异性免疫反应对宿主可能是有害的或保护性的,这取决于所涉及的肽。例如,Gil-Cruz和同事证明了多形芽孢杆菌衍生的β-半乳糖苷酶和宿主心肌肌球蛋白重链6之间的同源性如何驱动致命的自身免疫性炎症性心肌病;相反,Nanjundappa和其他人报道了类杆菌属物种衍生的整合酶和宿主胰岛特异性葡萄糖-6-磷酸酶催化亚单位相关蛋白(IGRP)之间的交叉反应,如何劫持自身反应性CD8+ T细胞来抑制结肠炎。最近的研究进一步扩展了这一交叉反应同源物列表,以包括外源性饮食抗原,特别是在HLA-DQ2.5介导的乳糜泻的情况下醇溶蛋白表位和肠道荧光假单胞菌衍生的琥珀酰谷氨酸去琥珀酸酶。癌症和微生物抗原之间的分子模拟也暗示该现象的存在。H-2Kb限制性T细胞免疫反应针对不同肠球菌菌株感染噬菌体与致癌驱动因子(PSMB4)交叉反应。口服含有这种噬菌体的大肠杆菌菌株后,在用环磷酰胺或抗-PD-1抗体治疗期间,可增强噬菌体特异性T细胞反应,有效对抗过表达PSMB4的肠外肿瘤。类似地,靶向短双歧杆菌共生菌中表达的表位SVYRYYGL (SVY)的T细胞与小鼠黑色素瘤B16-SIY表达的模型新抗原SIYRYYGL (SIY),发生交叉反应。此外,一些对天然黑色素瘤表位有特异性的人类T细胞被发现能识别微生物肽,这表明了其临床重要性。然而,增强抗肿瘤免疫的分子模拟物以外的机制也必须存在。例如,Tanoue和他的同事发现了一种11种细菌的混合物,在免疫检查点阻断的情况下,它增加了肿瘤抗原特异性CD8+ IFN-γ+ T细胞,这些细胞与微生物抗原没有交叉反应,也不是来源于结肠。
源自肠道的代谢物也能调节免疫反应。当万古霉素通过增加DC抗原存在和伴随的CD8+ T细胞启动消除梭菌属衍生的免疫抑制代谢物(丁酸盐和丙酸盐)时,肿瘤病灶的放射治疗更有效;相反,肠道微生物来源的丙酸盐和色氨酸途径代谢物(1H-吲哚-3-甲醛、犬尿烯酸)被证明能在体内提供长期辐射防护。高血丁酸盐和丙酸盐水平也与小鼠和黑色素瘤患者对CTLA-4阻断的耐药性相关,伴随着调节性T细胞(Treg)比例的增加,DC和效应性T细胞激活的减少,以及对白介素-2的较低响应,尽管它们也被发现与抗-PD-1治疗期间更长的无进展生存期相关。此外,益生元粘蛋白增加粘蛋白的体外生长,降低了肠道微生物菌群和T细胞依赖性侵袭性黑色素瘤的生长动力学,降低了促炎和免疫抑制性白细胞介素-6、白细胞介素-1α、白细胞介素-10、白细胞介素-17A和白细胞介素-23细胞因子的血清水平;值得注意的是,益生元菊粉通过不同的作用模式发挥作用,促进肠道中双歧杆菌物种的优势,增强脾脏细胞毒性T淋巴细胞功能,克服黑色素瘤对MEK抑制剂的耐药性。
肠道菌群对TME的影响
肠道生态系统可以通过影响免疫环境、骨髓和淋巴细胞的流入以及炎症和代谢模式来影响局部和远处的肿瘤形成。肠道微生物菌群的分泌成分可能很重要:例如,外膜小泡(OMVs)可以将TME向pro-TH1模式(CXCL10,IFN-γ)重新编程,或者代谢物,包括丁酸盐和烟酸,可以介导Gpr109a依赖性诱导结肠上皮中的IL-18生成,并抑制结肠炎和结肠癌。
肿瘤相关、NOX2介导的髓系细胞ROS的产生因抗生素给药或无菌状态而减少,降低了奥沙利铂介导早期肿瘤遗传毒性的能力。类似地,共生微生物组针对肿瘤坏死因子-α(TNFα)(IL-1β、IL-12和Cxcl10)的产生对anti-IL-10R/CpG-ODN治疗产生反应,而抗生素、无菌或TLR4-/-状态减弱了这种响应和肿瘤坏死因子依赖性早期肿瘤坏死。为了支持共生菌对发展中的癌症的辅助作用,巴氏杀菌的粘蛋白青霉或其菌毛样TLR2激动剂通过诱导肠系膜淋巴结中产生肿瘤坏死因子α的细胞毒性T淋巴细胞,最终到达结肠粘膜来钝化氧化偶氮甲烷诱导的结肠炎和结肠癌的发生。Tet 2-/-小鼠的自发性肠道细菌移位也导致白血病前期骨髓增生(PMP),如果不加以控制,就会以白细胞介素-6依赖的方式导致白血病。一个完整的肠道微生物菌群后来被证明是防止遗传易感小鼠白血病进展所必需的。
肠粘膜的非造血成分也与TME相关。基因缺陷小鼠和BM嵌合体确定了RNF5(一种E3泛素连接酶)在严重黑色素瘤免疫监测中的作用。Rnf5-/-小鼠表现出抗菌肽分泌减少和回肠隐窝细胞死亡增加,引起肠道微生物群落组成的变化。肠损伤扩大了表达CCR7的树突状细胞向Peyer’s斑、mLNs和黑色素瘤引流LNs的移动,增加了产生γ-干扰素的T淋巴细胞肿瘤浸润。确定Rnf5-/-特异性微生物效应,将Rnf5-/-小鼠与野生型小鼠共饲养,或给予抗生素,在Rnf5-/-动物中口服灌胃后过量存在的11种物种(拟杆菌属和拟杆菌属)可以恢复肿瘤侵袭性。在另一项研究中,奥沙利铂诱导的隐窝caspase 3/7依赖性回肠凋亡与回肠粘膜中免疫原性细菌占优势相一致。这些共生菌群调控mLNs中滤泡性辅助性T细胞启动效应,最终导致小鼠和患者的B细胞活化、免疫球蛋白产生和结肠癌浸润性淋巴细胞浸润(TILs)。抗CTLA-4诱导的肠屏障功能障碍对于双歧杆菌来源的肌苷的系统移位也至关重要,通过在DC共刺激的背景下激活T细胞特异性腺苷2A受体(A2AR)信号,进而促进TH1激活和抗肿瘤免疫。这些例子说明屏障损伤伴随着局部微生物组的偏离或微生物代谢物的转移,这反过来使树突状细胞到GALT内外,并通过活化的辅助性或细胞毒性T细胞促进肿瘤床浸润。
TME不仅包括基质细胞、肿瘤细胞、内皮细胞和造血祖细胞衍生的免疫成分,还包括影响脑癌和非脑癌发生的肾上腺素能神经纤维的致密网络。有趣的是,肠神经系统神经元既受肠道微生物菌群的影响,又根据它们在肠道中的位置进行功能调节。微生物菌群反应神经元的一个子集可以独立于中枢神经系统影响代谢调控。这些发现表明粘膜或肿瘤共生与肿瘤神经支配之间的密切关系需要进一步研究。
肠道微生物菌群介导的抗癌药物效应
肠道微生物密切参与了包括抗癌药物在内的异生物质的生物转化,对临床癌症控制产生了意想不到的效果。例如,在前列腺癌中,醋酸阿比特龙(AA)被粘蛋白杆菌用作能源,并抑制依赖AA抑制的雄激素生长的棒状杆菌物种。因为粘蛋白杆菌是抗炎的,棒状杆菌是促炎的,它们相对丰度的这种变化增加了AA治疗的药理功效。粘蛋白杆菌的免疫调节作用,包括在PD-1阻断期间与应答者的关联,促使人们猜测粘蛋白杆菌的增加可能解释了AA在雄激素非依赖性前列腺癌中的疗效,尽管这仍有待在大量患者队列中进行测试。这些类型的双向药物-微生物菌群反馈回路值得进一步研究。
肿瘤内微生物菌群对TME的影响
目前对不同肿瘤类型内活微生物菌群的机制研究仍十分有限,尤其是在呼吸消化道外。但它们对TME的许多影响似乎抑制了局部抗肿瘤免疫。此外,据报道,肿瘤内微生物通过分泌的基因毒素,尤其是pks+大肠杆菌衍生的大肠杆菌素和脆弱杆菌衍生的毒素,对(i)胃肠道和泌尿道诱变具有癌症特异性作用;(ii)分别在胃癌和肺癌中由CagA介导或IL-17-产生γδ T细胞介导的炎症;(iii)通过胰腺癌中的直接微生物代谢(胞苷脱氨酶降解吉西他滨)或结肠直肠癌中癌细胞自噬的间接扩增的化学抗性;(iv)胰腺癌中通过宿主C3补体级联的真菌激活的肿瘤增殖;和(v)通过上调乳腺癌中的肿瘤基质金属蛋白酶或降低肺癌中的肿瘤免疫监视的转移。免疫学上,肿瘤内微生物通常通过模式识别受体(PRR)连接产生耐受性编程,其中TILs的比例较低,包括CD8+ T细胞,偶尔也有更多的CD4+CD25+FoxP3+ Tregs,如在结直肠癌、胰腺癌、乳腺癌和肺癌中观察到。然而,在某些情况下,肿瘤内细菌或其抗原的注射可能相反地提供免疫刺激作用,正如Coley的毒素和细菌癌症治疗的最新发展所证明的。在乳腺癌中,将SCID-beige和C57BL/6小鼠与肿瘤内梭杆菌进行比较的实验表明,淋巴谱系细胞是肿瘤内微生物菌群衍生的肿瘤免疫监视效应的关键介质。肿瘤内微生物菌群和免疫原性之间也有联系,包括差异黑色素瘤免疫治疗响应和三阴性乳腺癌相关,但它们的潜在机制仍未阐明。
肠外屏障与癌症微生物菌群
鉴于肠道屏障提供了最大的宿主-微生物界面和最大的微生物多样性,关于微生物菌群在肿瘤发生或癌症预后中的潜在影响的研究主要集中在该屏障上。这些研究可以揭示肠道微生物组成变化和受损肿瘤免疫监视之间的因果关系,甚至在肠道外恶性肿瘤中也是如此。然而,值得注意的是,肠外癌症可以在含有自身微生物菌群的组织中发展,并可能在肿瘤恶化中发挥作用。
例如,肺的表面积约为每公斤体重1 m2,并且不是无菌的。致癌基因驱动的小鼠原位肺癌模型实验,揭示了局部共生体可能受到致癌作用的干扰,触发肺泡巨噬细胞和白细胞介素-17之间的炎症串扰——产生导致肿瘤进展的肺γδ T细胞。最近在83例肺癌患者中提出了这一观察的临床重要性。Tsay等人强调,肺癌患者声门上微量吸入共生物可影响治疗响应和总生存期,这是由于免疫检查点抑制导致TH17介导的炎症恶化。
皮肤也被认为是我们最大和最外层的器官,通过其常驻微生物、角质形成细胞和皮肤免疫成分之间的紧密联系,通过代谢、先天和同源免疫反应来维持宿主体内平衡。皮肤微生物菌群的组成变化似乎会影响非黑色素瘤皮肤癌变。类似地,由持续的高风险人乳头瘤病毒感染引起的宫颈癌通常与偏离的宫颈菌群有关。共生体和病毒相关癌症之间相互关联,它们在肿瘤发生中的协同作用需要进一步研究,并且有必要探索癌症-微生物在其他肠外屏障的相互作用。
人体部位之间微生物组组成的变化与稳定的人类遗传学形成对比,后者仅表现出由体细胞嵌合和克隆性造血产生的微小变化。由于宿主组织和微生物都受到致癌作用的影响,微生物的遗传异质性可能为诊断和定位疾病提供了机会。例如,源自血液的TP53突变可以指示宿主癌症状态,并暗示大于25种的癌症类型;相反,溶盖链球菌(以前的牛链球菌)菌血症可以根据其胃肠道来源,来反映宿主癌症状态和类型 。基于微生物的诊断存在许多挑战,包括相对于宿主的低生物量和来自试剂或环境污染物的混杂。许多关于它们在癌症治疗期间的特异性、流行性和稳定性,或在抗生素给药期间的实用性的问题仍有待回答,并且必须在临床部署之前加以解决。
几乎所有基于微生物的癌症诊断都是基于测序的,并且集中在呼吸消化道内的肿瘤,例如结肠直肠癌、胰腺癌和肺癌。最近才提出,在呼吸消化道以外的癌症类型,如乳腺癌或脑癌,也可能存在具有独特组成的微生物菌群。Nejman等人和Poore等人提出了大于30种癌症类型中不同的肿瘤内微生物菌群(图3),提出了它们对基于血液的诊断的适用性,并提供了这些微生物在七种癌症类型中的肿瘤内空间分布和细胞内定位的影像学证据,尽管大多数癌症类型仍然缺乏影像学证据。
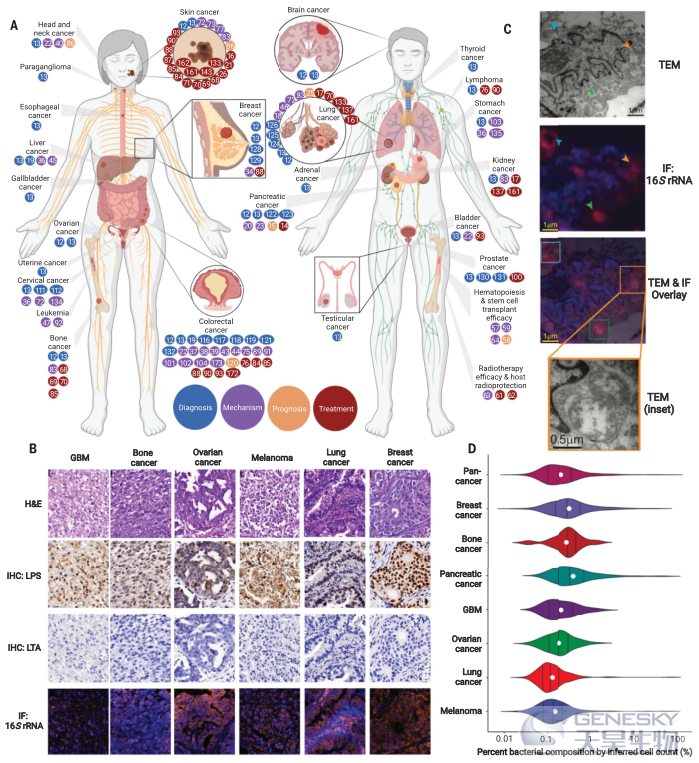
(A)目前与微生物菌群相关的所有癌症的汇总图,其中彩色点反映参考数字,并根据参考论文的主题(诊断、机制、预后或治疗)进行着色。Dots基于现有的临床前和临床数据。(B)六种癌症中脂多糖(LPS)和脂磷壁酸(LTA)的代表性组织学、免疫组织化学(IHC)和细菌16S rRNA的免疫荧光(IF)。H&E,苏木精和伊红;GBM,胶质母细胞瘤。(C)乳腺癌细胞内细菌16S rRNA免疫荧光重叠的代表性透射电镜(TEM)图像(箭头)。(D)估计七种癌症类型的肿瘤百分比细菌组成。黑线表示分布分位数(25%-50%-75%);白点反映平均值。
结合多区域16S rRNA扩增子测序、qPCR、免疫组织化学[脂多糖(LPS)、脂磷壁酸(LTA)]、免疫荧光(16S rRNA)、培养和电子显微镜,Nejman等人调查了1010个黑色素瘤、肺癌、卵巢癌、胶质母细胞瘤、胰腺癌、骨癌和乳腺癌肿瘤中的细菌。他们包括811个实验对照,涵盖了DNA提取、PCR扩增和石蜡包埋,鉴定并去除了94.3%的细菌污染物。检查残留了528种细菌,发现不同癌症类型在组成、多样性和推断的代谢功能上存在显著差异。组织学成像揭示了异质微生物的空间分布(图3B),及其在癌症和免疫细胞中的细胞内定位(图3C)。如上文“癌症微生物菌群概述”部分所述,在假设组织同质性和每个癌细胞8 pg的DNA条件下,我们利用qPCR估计了每个组织切片中的细菌数量,用图表描述了每个癌症类型的细菌组成百分比(图3D)。将他们的应用于黑色素瘤免疫治疗队列表明应答者和非应答者之间的微生物组差异,但还不是一种机制。因为细菌仅从五种人类乳腺肿瘤中培养,这项研究中肿瘤内细菌的广泛生存能力尚不清楚,特别是在据报道细菌较少的癌症中。然而,其他研究确实显示,在乳腺癌、肺癌、前列腺癌、胰腺癌和结肠癌中存在可培养的细菌,这表明微生物具有广泛的生存能力。尽管如此,关于这些肿瘤内微生物菌群的功能影响以及它们是寄生、共生还是被动乘客的基本问题仍然存在,并且需要活检标本进行分析,限制了其诊断用途。
Poore等人采取了不同的方法,从TCGA数据库中收集了所有治疗性的全基因组和转录组研究(n = 18,116个样本;33种癌症类型)来研究细菌、病毒和古细菌核酸。由于没有可用的实验对照,他们过滤掉了历史上已知的试剂污染物,并使用每个样本的DNA和RNA浓度推断出其他污染物;这些步骤去除了高达91.3%的微生物分类群。机器学习揭示了肿瘤内癌症特异性微生物特征。因为结肠癌在流行病学上与临床菌血症相关,他们研究了TCGA血液来源的正常样本(n = 1866个样本)的癌症特异性微生物DNA,并报道了高度准确的癌症鉴别。他们通过比较100名肺癌、前列腺癌或黑色素瘤患者的血浆来源的cfDNA和69名HIV阴性健康患者的血浆来源的cfDNA,同时实施必要的实验污染控制,验证了这种基于血液的诊断方法。由于TCGA缺乏实验控制,仅依赖深度测序数据而没有正交方法,以及目前缺乏可解释的微生物DNA进入循环系统的机制研究,都限制了进一步的发现。Nejman等人确定的癌症和免疫细胞中的细胞内细菌可能提供了一个来源,尽管这仍有待证明。严格的评估以及来自非致死性身体感染患者、败血症患者和癌症治疗期间接受抗生素治疗的患者的血液样本是广泛临床应用的必要前提。
某些胃肠道微生物菌群和全身淋巴组织活性之间的联系,激发了人们对微生物调节作为一种强有力的免疫治疗方式的兴趣。如初步数据所示,如果肿瘤内微生物菌群最终被证实在大多数患者中普遍存在且具有免疫活性,则此类干预措施必须考虑微生物生态位及其串扰(图4)。这些动态有时看起来是相关的;例如,肠道微生物菌群的调节可能通过胰管连通影响胰腺癌肿瘤内微生物菌群的组成。然而,在其他情况下,这些变化是不协调的;例如,抗生素似乎通过抑制肠道微生物菌群来消除免疫治疗反应,但矛盾的是,当消除胰腺肿瘤内微生物菌群时,它们通过上调PD-1的表达来提高免疫治疗效果。在癌症治疗中应用益生元、益生菌、后生元制剂和抗生素之前,这些复杂性要求对调节方法进行更深入的机理研究,并有更好的临床理解。
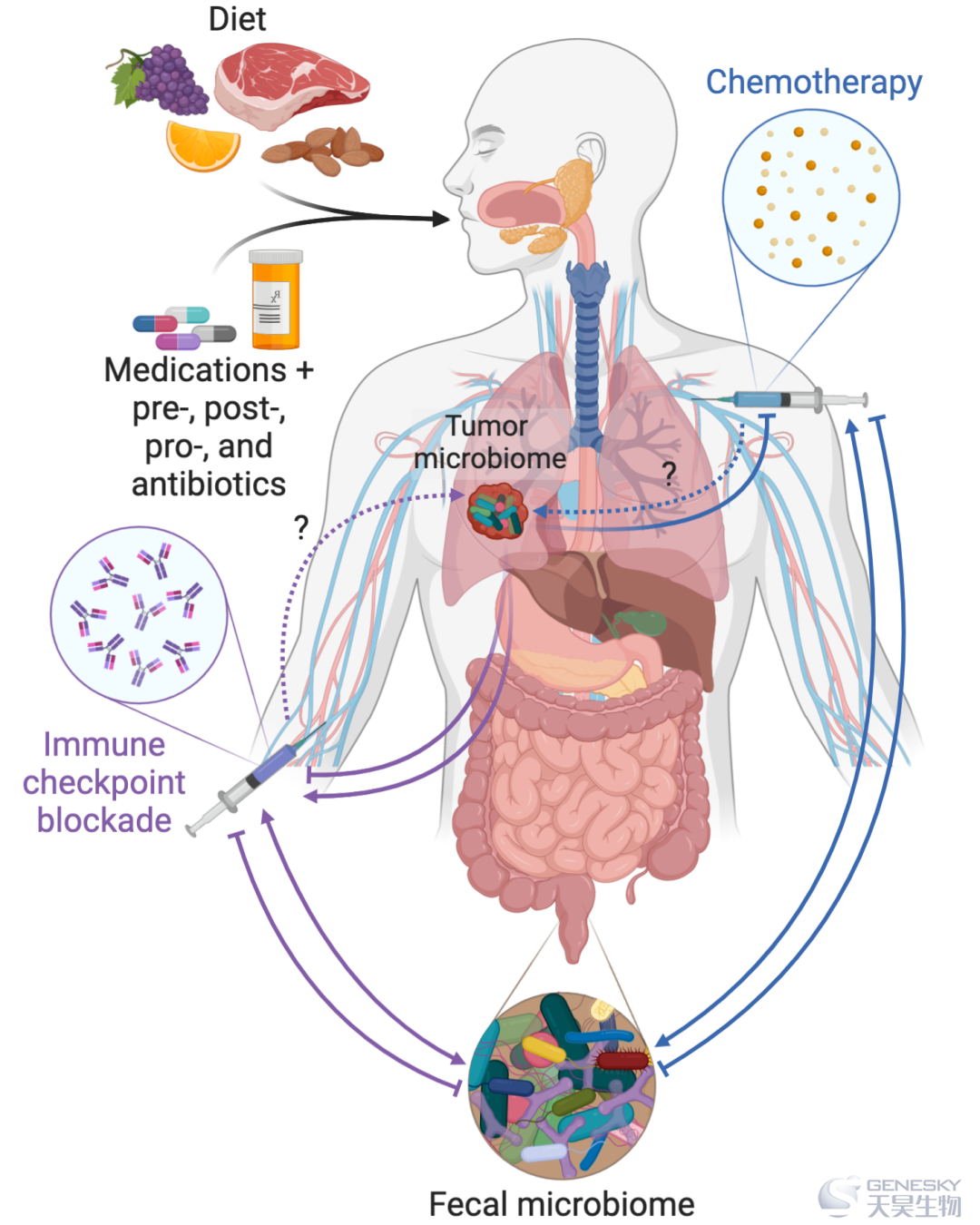
饮食、药物、益生元、益生菌和抗生素都有能力改变肠道和肿瘤微生物菌群。这些微生物菌群和癌症疗法(化疗和免疫疗法)之间可能存在双向影响。例如,化疗可以引起肠道微生物组的组成变化,进而提高治疗效果;在其他情况下,化疗可能被微生物破坏。因此,肠道和/或肿瘤微生物组的改变可能对一种治疗方式有利,而对另一种不利。虚线箭头表示文献中的空白。
抗生素和癌症微生物菌群
在癌症中使用抗微生物疗法仅限于解决或预防已知的微生物致癌物。这包括用三重或四重抗生素疗法治疗幽门螺杆菌导致的胃淋巴瘤,施用针对活性丙型肝炎病毒的直接作用抗病毒药物,接种针对人乳头瘤病毒血清型和乙型肝炎病毒的疫苗,以预防泌尿生殖系统、宫颈癌、头颈癌和肝癌。排除抗生素导致的化疗(如阿霉素),在实体瘤中使用抗生素有间接的和相互矛盾的证据。对肺癌、结肠癌和胰腺癌的几项研究表明,消除肿瘤内微生物菌群可以抑制促肿瘤炎症过程,减少细胞增殖,或将耐受性TME转化为免疫原性。然而,越来越多的临床证据表明,系统性抗生素消除了免疫检查点阻断的功效,降低了患者的生存率。在血液系统恶性肿瘤中,临床前证据表明了一种谨慎的平衡,即抗生素或肠道细菌移位可在遗传易感宿主中引发白血病进展。
改变微生物菌群的益生元、后生元和饮食干预也很有希望。最近详细回顾了饮食对癌症的影响,有许多流行病学联系,但很少有因果机制。饮食数据收集方面的困难阻碍了强有力的结论,但是可以揭示饮食摄入和伴随的小分子效应物的代谢组学数据在未来可能会有所帮助。益生元(促进有益微生物生长的分子)如抗性淀粉、菊粉和粘蛋白在临床前模型中很有前景,可以提高黑色素瘤和结肠癌的抗肿瘤免疫和治疗响应,并且正在进行临床试验(例如NCT03870607、NCT03950635)。后生元化合物(微生物来源的分子)在癌症中的实验证据有限,但它们可以通过确定的组成和生产再现性提供优势。
肠道微生物菌群也可以通过粪便微生物菌群移植(FMT)、特定微生物菌群的施用和商业益生菌来调节癌症。FMT有效治疗艰难梭菌结肠炎,在治疗免疫治疗相关结肠炎方面有一定疗效。FMT的长期疗效和稳定性仍然未知。抗生素预处理、给药途径、调节频率和饮食建议等因素使临床靶向肠道微生物变得复杂(142)。正在进行的临床试验表明,来自对免疫疗法有反应的供体的FMT可能增强抗肿瘤免疫和潜在的临床反应[NCT03353402]。其他临床试验正在评估转移微生物联合体的影响,范围从单克隆细菌菌株到多重联合体。很少有市售益生菌制剂被用来测试抗肿瘤和对全身免疫的影响,某些制剂实际上增加了肿瘤的发生。在危重患者中,商业益生菌的使用甚至可能导致菌血症。因此,应劝阻癌症患者滥用市售益生菌。
在为癌症治疗设计外源性细菌和病毒药物方面,目前已经取得了一些重大进展,特别是强有力的免疫疗法或新辅助疗法。有两种这样的药物获得了FDA的批准:使用塔里莫根拉赫帕瑞韦克(T-VEC)治疗晚期黑色素瘤的溶瘤病毒疗法和使用活减毒牛分枝杆菌(卡介苗)治疗高危非肌层浸润性膀胱癌的细菌性癌症疗法。因为溶瘤病毒是非定量的,并且已经在其他文章中进行了详细的总结,我们将注意力集中在细菌癌症治疗(BCTs)上。尽管历史上争议不断,但BCT正在通过合成生物学技术重新获得关注,这些技术在增强局部抗肿瘤免疫的同时,有计划地限制全身毒性。BCT药物的监管挑战相当大(图5A),尽管正在进行临床试验(如NCT04167137),但它们仍有待商业上的超越。
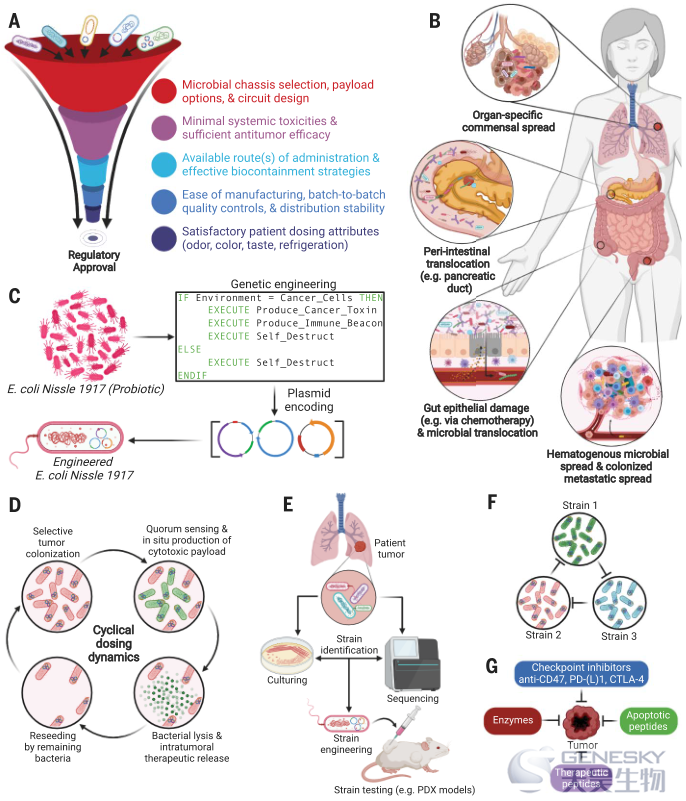
(A)工程菌抗癌的监管考量。(B)肿瘤内细菌的不同来源包括器官特异性共栖、肠道交流、血液性传播和细胞内传播。(C)一些益生菌,如大肠杆菌尼斯勒1917,具有很强的安全性记录,已被证明可以在动物模型中自然迁移到实体瘤,并且可用于实体瘤内部的生成和递送疗法。(D)复杂的群体动力学可以设计为治疗药物的循环输送。(E)未来的努力方向可能会集中在在患者特异性肿瘤中自然发现菌株的工程和测试上。PDX,病人来源的异种移植。(F)工程生态可以用来设计产生定制的、肿瘤特异性的治疗混合物。(G) 针对肿瘤的多种药物有效载荷可以由一种或多种工程菌株编码。
作为抗癌药物的工程微生物
肿瘤趋向性的天然细菌机制很多(图5B),肿瘤内或静脉注射通常导致肿瘤中药物相对于肝、脾和肺组织出现约10,000倍的积聚。这种对肿瘤组织的亲和力提供了一个创造性的药物策略,建立从合成生物学到癌症治疗的天然桥梁,由此细胞毒性有效载荷可以被肿瘤返回细菌进行编码,用于程序化递送(图5,C至G)。迄今为止,大肠杆菌、双歧杆菌、李斯特菌、志贺氏菌、梭菌、乳球菌、弧菌和沙门氏菌的基因减毒型、营养缺陷型和诱导型已被改造,并在临床前模型中通过静脉、瘤内和口服给药途径显示出抗肿瘤功效。虽然一些方法是基于通过细菌的吞噬吸收在细胞内递送药物,但其他方法将细菌编程为充当“肿瘤内生物反应器”,作为定殖的一部分,在细胞外持续产生和释放有效载荷。一种有趣的通用方法是实施工程细菌裂解,只有当达到预定的细菌种群密度时,才能产生或释放抗肿瘤蛋白。这大大减少了细菌菌落的大小,防止了全身毒性。Din和他的同事首先证明了如何改造非致病性大肠杆菌和沙门氏菌,使其在临界群体密度下裂解,以期望的周期间隔向TME释放趋化因子、溶血素或促凋亡蛋白,或所有这三种物质。随着细菌种群被编程为产生-死亡-再生长周期,来进行药物的循环输送。Chowdhury等人随后使用这种设计来产生和释放抗CD47的抗体片段纳米体,肿瘤可以过度表达该抗体片段,进而抑制DC吞噬作用。有趣的是,这刺激了肿瘤抗原特异性CD8+ T细胞反应,阻止了转移并介导了脓肿效应,这也使远端非注射肿瘤消退。这种方法进一步排除了宿主贫血和血小板减少症,后者通常在系统性CD47拮抗作用中出现,提示有临床机会。如果肿瘤内细菌被证明在各种癌症类型中普遍存在,裂解循环设计也可以提供一个机会来灵活地设计患者特异性的、肿瘤特异性的共生菌株(图5E)或几个相互作用的菌株(图5F),以调节有效载荷的释放。考虑到许多可编码的细胞毒性有效载荷(图5G),BCT临床疗效的明确证明和最小的全身毒性可以显著增加癌症治疗设备。
过去15年的微生物研究,为微生物和癌症之间的关系,以及这些关系的细微差别,提供了有趣但仍有争议的证据。很少有微生物直接导致癌症,但更多的微生物似乎是同谋,有几种微生物促进宿主抗肿瘤免疫。这种复杂性可能反映了宿主免疫系统、共生微生物菌群和我们刚刚开始发现的致瘤过程之间共享的进化动力学。
针对癌症微生物菌群的临床观察和临床干预仍然存在很大的文献空白。尽管鼠免疫治疗模型中的肠道微生物菌群调节提供了可喜的结果,但它们尚未转化为人类的商业治疗干预。此外,基于对人类和小鼠肠道微生物的研究,对治疗反应,特别是免疫治疗进行分层,并没有显示出非常显著的分类差异。因此,20世纪初困扰研究人员的许多关键问题——污染、不可再生性、患者毒性——今天仍然是基于微生物的癌症诊断、预测和外源微生物治疗的挑战。需要使用精心挑选的样本来限制和减轻潜在污染的额外队列,以帮助描述和理解肿瘤内微生物对癌症发生发展和治疗响应的影响。需要努力来检查非细菌与癌症、胃肠和肿瘤内的关系,以及它们的功能,特别是与已知细菌功能的关系。有必要进一步开展联盟层面的工作,以评估技术变量(例如DNA提取、样本处理、生物信息学方案)对癌症微生物组数据的影响,并指导“金标准”管道的选择,类似于微生物组质量控制联盟在15个实验室和9个生物信息学方案中对粪便扩增子测序的分析。
这些挑战中的许多将得到多中心、纵向、协同努力研究癌症微生物菌群的帮助,类似于TCGA在阐明体细胞突变景观中的作用,包括联合肿瘤、血液和粪便收集,多组学数据生成,以及实验污染控制的结合(图6)。微生物菌群调节试验的完成对于指导临床应用和增加癌症治疗医疗设备也是至关重要的,新的证据表明在免疫治疗难治性黑色素瘤患者中使用FMT调节肠道微生物菌群,与临床响应以及肠道和肿瘤免疫微环境的变化有关。在群落和单个微生物尺度上的深入功能分析,可能是阐明微生物-免疫-癌细胞机制相互作用所必需的。正如最近大肠杆菌素诱变研究所证明的,具有免疫和微生物生态位或工程菌和代谢物,可能进一步有助于验证或反驳致癌作用中的微生物因果关系或辅助作用。尽管仍然存在许多挑战,但更好地理解微生物在癌症中的作用,可能会为改善患者护理提供一种强大的新工具包。
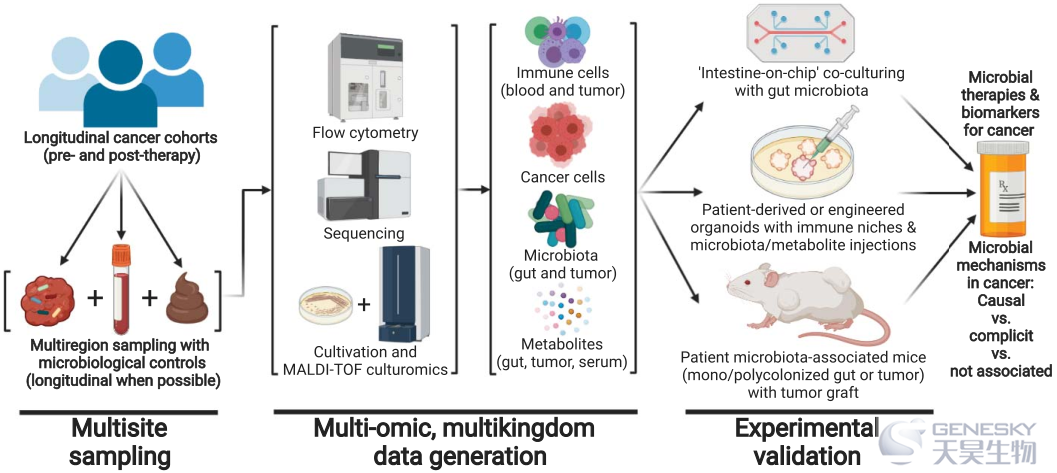
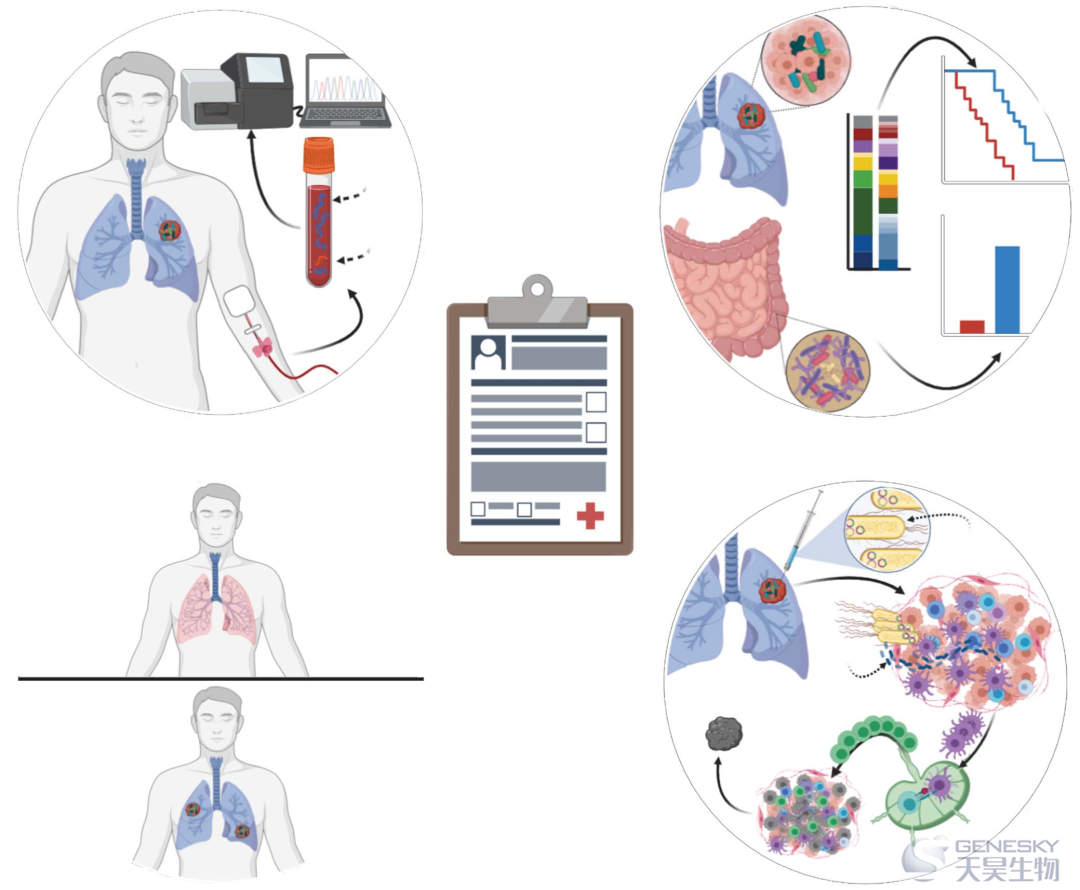
图6、表征癌症相关微生物菌群及其功能影响的研究设计
从纵向队列和多区域取样开始,有机会对癌症相关微生物菌群的存在和功能进行大规模鉴定。现有工具可用于收集宿主免疫细胞、癌细胞、微生物菌群和代谢物的多组学信息。然后,患者肿瘤和肠的体外和体内疾病模型,可用于验证或反驳给定微生物(或其代谢物)的预测功能影响和机制,以及其致癌因果关系。MALDI-TOF,基质辅助激光解吸电离飞行时间质谱。
往期链接:
Nature综述 |人类代谢健康和疾病中的肠道菌群;
综述速递 | 宿主-肠道微生物菌群相互作用代谢调节中关键物种的鉴定;

咨询沟通请联系
18964693703

创新基因科技,成就科学梦想

 咨询热线:400-065-6886
咨询热线:400-065-6886

 咨询热线:400-065-6886
咨询热线:400-065-6886








