2021年11月m6A RNA甲基化研究领域的10分以上文章有6篇,现精选这些研究的主要结果供大家阅读欣赏.

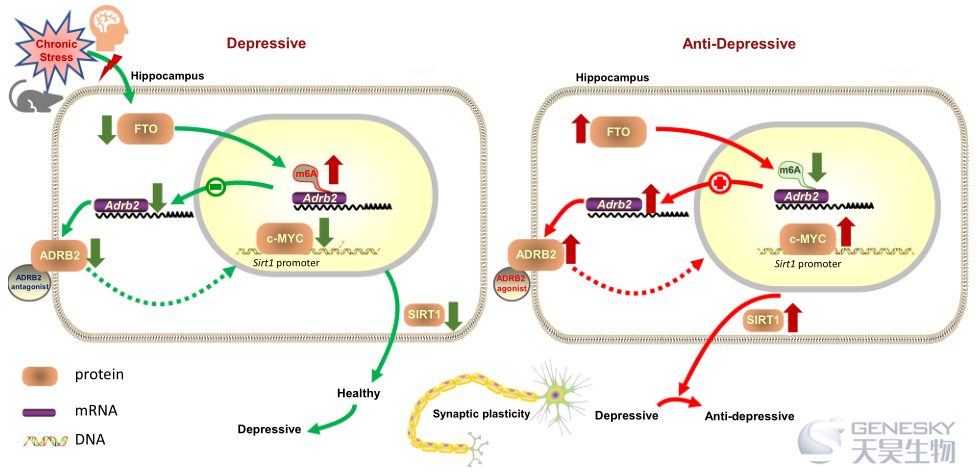
北京协和医学院许琪课题组近日在NC发文报道FTO调控RNA甲基化与抑郁样行为有关。RNA的转录后修饰,如RNA甲基化,可以在表观遗传学上调节行为,如学习和记忆。然而,目前尚不清楚RNA甲基化在重度抑郁症(MDD)的病理生理中是否起着关键作用。这一研究报道了脂肪量和肥胖相关基因(FTO),一种RNA去甲基化酶的表达在MDD患者和抑郁小鼠模型的海马中下调。抑制小鼠海马中的Fto表达会导致成年小鼠的抑郁样行为,而过表达Fto会导致抑郁样表型的挽救。通过Fto敲降、敲除和过表达小鼠海马m6A RNA甲基化的表观转录组分析,可以识别肾上腺素受体β2 (Adrb2) mRNA作为Fto的靶点。ADRB2刺激可能通过c-MYC调节海马SIRT1的表达,挽救了小鼠的抑郁样行为和海马Fto缺乏引起的脊柱缺失。这项研究结果表明,FTO是小鼠抑郁样行为潜在机制的调控因子。

内质网(ER)腔内未折叠或错误折叠蛋白的积累可引发应激适应的未折叠蛋白反应(UPR),其失败可导致细胞凋亡和组织/器官损伤。UPR如何选择应激适应而非凋亡的分子开关仍然未知。该研究发现未折叠/错误折叠蛋白的积累选择性地诱导N6-腺苷甲基转移酶-14 (METTL14)的表达。METTL14通过3’UTR m6A促进C/EBP同源蛋白(CHOP) mRNA衰减,抑制其下游促凋亡靶基因表达。UPR通过与HRD1-ER相关降解(ERAD)机制竞争,诱导METTL14表达,阻断METTL14泛素化和降解。因此,肝脏特异性METTL14缺失的小鼠对急性药理学和α-1抗胰蛋白酶(AAT)缺乏诱导的ER蛋白毒性应激和肝损伤高度敏感。进一步的肝脏CHOP缺失保护了METTL14敲除小鼠免受ER应激诱导的肝损伤。这项研究揭示了内质网应激和mRNA m6A修饰通路之间的相互作用,称为ERm6A通路,用于内质网应激适应蛋白质毒性。

小细胞肺癌(SCLC)是一种毁灭性的肺癌亚型,治疗方法很少。尽管免疫治疗的出现,以铂为基础的化疗仍是SCLCs不可替代的一线治疗方法。然而,耐药在大多数患者中总是会发生,并且结果是不同的。因此迫切需要临床可行的分型策略和潜在的治疗靶点来克服化疗耐药性。m6A是一种新的表观遗传决定因子,参与肿瘤进展和耐药。然而,关于SCLC中m6A修饰几乎一无所知。该研究评估了来自三个不同队列的接受化疗患者的200例SCLC样本,包括一个验证队列包含71例qPCR数据和一个独立队列包含79例免疫组织化学数据。研究系统地描述了m6A调节因子在SCLC患者化疗后的预测前景。使用LASSO Cox模型,研究人员构建了基于7个调节因子(ZCCHC4, IGF2BP3, ALKBH5, YTHDF3, METTL5, G3BP1和RBMX)的化疗获益预测分类器(m6A评分),随后在另外两个队列中验证了该分类器。时间依赖的ROC和C指数分析显示,与其他临床病理参数相比,m6A评分具有更好的化疗获益预测能力。一项多队列多变量分析显示,m6A评分是影响多个队列生存获益的独立因素。体外实验结果显示,三种调节因子ZCCHC4、G3BP1和RBMX可能成为克服SCLC耐药的新的治疗靶点。该结果首次证明了m6A调节因子对化疗获益的预测意义,以及它们作为克服SCLC患者化疗耐药性的治疗靶点的潜力。m6A评分被发现是一个可靠的预后工具,可能有助于指导SCLC患者的化疗决策。

越来越多的证据表明,m6A调节因子参与了结直肠癌(CRC)的病因和进展。然而,m6A阅读器参与糖酵解代谢的确切机制仍不清楚。本文旨在通过m6A与糖酵解代谢的交互作用,揭示CRC进展的新机制。研究发现在CRC增殖和进展过程中,m6A阅读器IMP2与长链非编码RNA ZFAS1的相互作用依赖于m6A调控,随后增加了OLA1的募集以及ATP水解和糖酵解。特别地是,在CRC细胞和配对CRC队列(n = 144)中,IMP2和ZFAS1显著过表达,m6A水平升高。这些指标可作为CRC预后预测的独立生物标志物。值得注意的是,IMP2调控ZFAS1表达,促进CRC细胞增殖、菌落形成和凋亡抑制。因此,它是致癌的。从机制上看,ZFAS1在RGGAC/RRACH元件中以m6A依赖的方式在腺苷+843位置被修饰。因此,IMP2的KH3-4结构域和ZFAS1之间的直接相互作用对CRC的发展至关重要,其中IMP2作为m6A修饰的ZFAS1的阅读器,促进ZFAS1的RNA稳定性。更重要的是,稳定的ZFAS1识别OLA1的OBG型功能域,促进ATP结合位点(NVGKST, 32-37)的暴露,增强其蛋白活性,最终加速ATP水解和Warburg效应。这项研究结果揭示了一种新的促癌机制,即m6A 阅读器所在的关键调控网络稳定lncRNAs,并在CRC发病机制中共同促进线粒体能量代谢

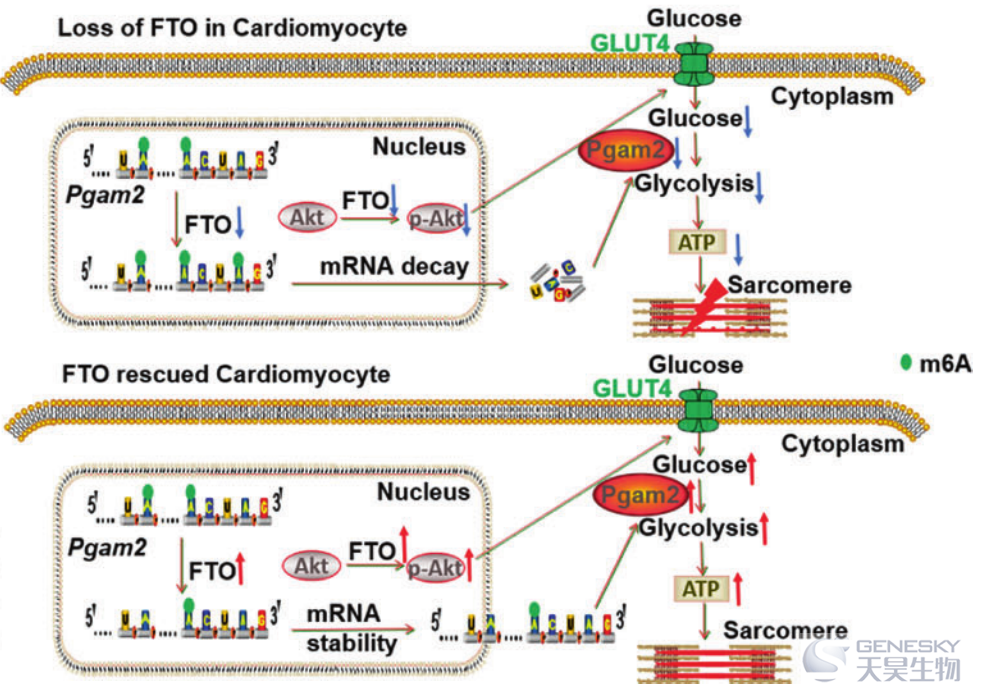
m6A是哺乳动物中最常见的转录后mRNA修饰,参与多种生物学过程和疾病。然而,其在心力衰竭(HF)期间心脏能量代谢变化中的作用仍不清楚。这项研究利用MeRIP-seq发现主动脉缩窄(TAC)小鼠模型的心脏组织m6A peak数高于对照组,m6A peak主要富集在3’ UTR区。GO分析发现TAC后m6A改变特异性富集在代谢相关的mRNA上,KEGG也显示糖酵解相关基因显著富集。为了进一步寻找HF中改变m6A修饰模式的驱动因素,研究人员分析m6A修饰酶在TAC八周后显著降低,而FTO下调是最主要的因素。FTO过表达在TAC八周后显著减轻心脏功能异常,与对照相比,FTO过表达组心脏纤维化和肥大明显改善,体内心脏糖吸收显著增加,而FTO敲低呈现相反的表型。进一步在体外研究FTO对代谢的影响发现FTO敲低显著降低了心肌细胞糖酵解能力,并且扰乱了ATP产生。PGAM2可能至少部分参与了Ang II刺激后TAC小鼠和心肌细胞中FTO敲低引起的糖酵解变化。这项研究是第一个利用功能缺失和功能获得方法在系统探索m6A和FTO在TAC诱导的HF小鼠模型中心脏代谢的调节作用。

m6A是真核细胞中最丰富的RNA修饰,在癌症中发挥重要作用。虽然大多数相关研究集中在线性RNA中的m6A修饰,但在转录组范围内分析和探索肿瘤中环状RNA中的m6A修饰仍然缺乏。为了检测环状RNA中的m6A修饰,研究人员开发了一种新的生物信息学工具Circm6A,并将其应用于58例胰腺导管腺癌(PDAC)患者77个组织样本的m6A-seq数据中。结果显示Circm6A的性能优于现有的circRNA识别工具,在检测m6A修饰的circRNA时,该工具F1得分最高。通过使用Circm6A,从m6A-seq数据中鉴定了8807个m6A-circRNAs。与正常组织相比,PDAC肿瘤组织中的m6A-circRNAs倾向于高甲基化。高甲基化的m6A-circRNAs与circRNA-mRNA共表达网络的显著增加相关,导致许多重要的癌症相关通路的失调。此外,研究显示高甲基化m6A-circRNAs可能促进circRNAs的环化和翻译。这些综合性的发现通过描述PDAC患者的m6A-circRNAs基因组图谱,进一步弥合了m6A修饰和circRNAs领域之间的知识鸿沟,揭示了m6A-circRNAs在胰腺癌中所扮演的新角色。Circm6A可以在https://github.com/canceromics/circm6a网站中获取。
天昊生物具有多年基因组、转录组和表观组等多组学检测与分析的经验,m6A RNA甲基化作为表观领域的一大热点,天昊生物自主设计了m6A调控因子(writers/erasers/readers)差异表达分析检测panel,还可以提供m6A修饰整体水平定量检测,并结合MeRIP-seq和RNA-seq挖掘受m6A调控因子影响的下游靶点,同时可对相关的靶点进行MeRIP-qPCR验证。生信团队亦可提供个性化的m6A数据库挖掘与生信分析内容。
咨询沟通请联系
18964693703(微信同号)

创新基因科技,成就科学梦想

 咨询热线:400-065-6886
咨询热线:400-065-6886

 咨询热线:400-065-6886
咨询热线:400-065-6886