
 咨询热线:400-065-6886
咨询热线:400-065-6886

 咨询热线:400-065-6886
咨询热线:400-065-6886
肠道和其他部位的微生物可能在癌症的发生、癌症免疫监测形成和免疫疗法反应中具有重要作用。我们对宿主与微生物之间的复杂关系,以及它们对健康和疾病影响的理解有了很大的进展,这加速了针对微生物群的新治疗策略的开发,以改善癌症的治疗效果。因此,对患者微生物组成和功能的评估及其随后的靶向调节,是未来多学科和精确医学方法的关键因素。在这篇综述中,作者概述了利用微生物组更好地预防和治疗癌症的研究现状。
微生物作为地球上最古老的生物,是创造更适宜居住的环境的原因。长期以来,微生物一直在塑造我们的星球和我们的环境,生活在个体有机体中的微生物对宿主生理学有着深远的影响——能够影响整体健康和疾病状态。这包括存在于人体胃肠(GI)系统中的大部分微生物,它们影响许多生理过程,包括消化、代谢、认知以及免疫系统发育和功能。重要的是,胃肠道和其他生境中的微生物也可以促进疾病的发展,包括癌症。
在过去十年中,癌症治疗中最具变革性的进展之一涉及免疫疗法的使用,这种方法被整合到几乎每种癌症类型的治疗中。具体来说,免疫检查点阻断(ICB)治疗显著提高了多种癌症类型的存活率。然而,ICB的全部治疗潜力仍然没有完全实现,因为不是所有的患者都获得了持久的益处,相当大比例的患者表现出对治疗的原发性或获得性抗性。这为发现新的策略来改善反应和克服对这种强有力的治疗形式的耐药性留下了机会。
研究已经确定了与ICB反应相关的宿主基因组和分子生物标志物。实验结果也表明宿主固有的微生物及其基因(统称为微生物组),特别是那些存在于胃肠道内的微生物,影响了对ICB的反应。不同的肠道微生物可以将健康个体与癌症患者,以及ICB治疗的癌症队列中无应答者的应答者区分开来。这些发现促进了基于微生物组的治疗策略的实施,通过调节患者肠道微生物及其功能,以增强对ICB的临床反应并消除对治疗的毒性反应。目前,一些干预策略,如粪便微生物群移植(FMT)、益生元、益生菌和抗生素治疗以及饮食干预,已显示出作为肠道微生物群调节剂的早期前景。然而,肠道微生物群的最终治疗作用与它的功能状态,及其有利地影响全身免疫和整体宿主健康的能力有关。因此,表征肠道微生物组相关的系统生物学功能和潜在的分子机制对于发现新的、可操作的靶点以进行未来干预和临床评估至关重要。
除了肠道微生物组,我们现在正进入研究和操纵肿瘤内微生物组阶段,以改善癌症治疗的临床反应。肿瘤微环境(TME)是一个吸引微生物生长的环境,已经在癌症患者的肿瘤中鉴定出相关微生物。现在利用下一代测序(NGS)技术,使人们对实体恶性肿瘤中肿瘤内微生物组的局部多样性和功能的相关性有了更深入的了解。然而,其最终作用仍未完全确定,因为某些微生物似乎促进肿瘤发生,而其他微生物通过充当免疫佐剂来帮助抗肿瘤免疫反应。事实上,与它们的肠道相关对应物不同,反应相关的肠道内微生物组特征的综合表征仍处于起步阶段。然而,现在存在新的研究和治疗机会来靶向肿瘤内微生物进行拦截、处理,甚至可能完全预防癌症。
在这篇综述中,我们讨论了肠道和肿瘤内微生物群在癌症发展和治疗反应中的相关性,突出了最近推动该领域向前发展的关键研究。我们强调了新出现的和未来的策略,这些策略试图操纵这些微生物组以提高癌症治疗效果,最后,我们讨论了未来5到10年微生物个性化癌症治疗的潜在策略。
除了特定胃肠道细菌在局部致癌作用中的既定作用(例如胃癌中的幽门螺杆菌和结肠直肠癌(CRC)中的具核梭杆菌)。现在清楚的是,胃肠道(肠道)内的微生物也可以在全身水平上形成整体免疫力并影响健康和疾病(包括癌症)状态(表1)。这是由系统免疫成分和炎症标记物、组织免疫和肿瘤免疫以及肠道和肿瘤微生物群之间的动态相互作用介导的。重要的是,微生物群现在被确定为“癌症标志”中的因素之一。
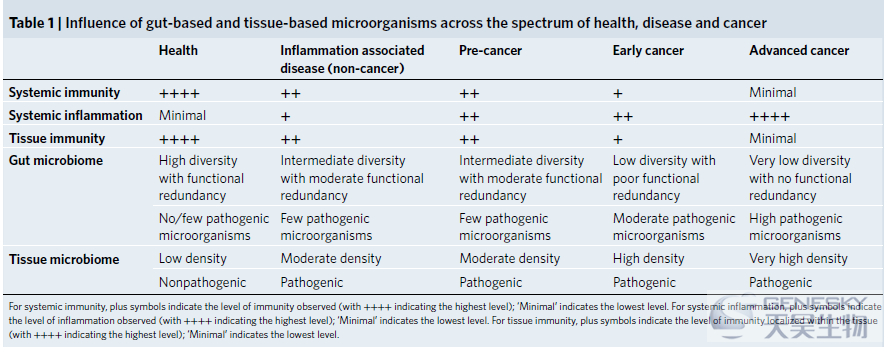
系统免疫和癌症治疗反应的作用机制
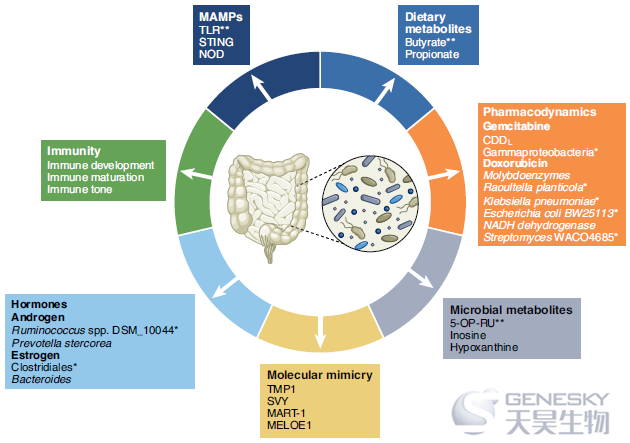
临床前证据
肠道微生物对全身免疫的影响的临床前和临床证据是多方面的。例如,无菌小鼠(在无菌环境中长大)的免疫系统不成熟,缺乏成熟的二级和三级淋巴器官,无法对疫苗接种做出反应。此外,在无特定病原体条件下饲养的小鼠中,由广谱抗生素的组合引起的胃肠道内的细菌多样性降低,对化疗药物如环磷酰胺或奥沙利铂的疗效产生负面影响,都部分通过免疫机制发挥作用。广谱抗生素的使用也对临床前模型中的靶向细胞毒性T淋巴细胞相关蛋白4(CTLA-4)的ICB,或程序性细胞死亡蛋白1/程序性死亡配体1 (PD-1/PD-L1)治疗结果产生负面影响。值得注意的是,有研究尝试通过从癌症患者的FMT预处理小鼠,来预测患者对PD-1阻断反应或无反应的潜在能力,但这种方法没有被广泛使用,并需要进一步的研究和验证。
临床证据
与临床前模型的证据一致,大量研究表明,与未接受抗生素治疗的患者相比,在ICB治疗前不久或期间接受广谱抗生素治疗的癌症患者的无进展生存期(PFS)和总生存期较短。这支持了一个假设,即不受干扰的和多样化的微生物群落对于有效的癌症免疫监测是必不可少的。同样,失衡的微生物群落对癌症免疫循环有负面影响。事实上,在几种癌症类型中,与无癌症个体相比,活动期癌症患者肠道中某些微生物类群的相对丰度增加(图2a),尽管这些肠道微生物和致癌作用之间的因果关系尚未确定,进一步的调查显然是必要的。此外,在所研究的几种癌症类型中,特定的微生物分类群与对ICB的反应相关——在这些组群中发现了一些统一的细菌分类群(图2b)。

图2、与癌症诊断或对ICB反应相关的肠道微生物群落特征。a) 在Yonekura等人最近的工作中描述了一项基于鸟枪法宏基因组的粪便分析,该分析是从超过1900名患有不同阶段的八种不同恶性肿瘤的癌症个体中收集的,并与来自超过5500名健康个体的粪便进行了比较。LEfSe以及相对分类丰度的成对比较,证明了健康个体肠道微生物群中所选分类群(蓝色)的过度表达,以及癌症个体肠道微生物群中其他分类群(红色)的相对过度表达。b) 显示了14项研究的数据,这些研究分析了癌症患者粪便的分类组成对不同癌症类型和阶段(III和/或IV)以及地理位置(法国、欧洲、美国、加拿大、日本和中国)差异。CMML,慢性粒单核细胞白血病;HCC,肝细胞癌;NSCLC,非小细胞肺癌;HBC,肝胆管癌。
对治疗相关毒性的影响
除了与反应相关的微生物种类特征识别外,肠道中的特定微生物分类群和失调也与治疗相关的毒性相关(与ICB、干细胞移植和其他癌症治疗相关)。这些发现分别使用FMT疗法或靶向微生物调节疗法等技术,提供了恢复健康微生物群或靶向特定微生物的机会,以减少治疗相关的毒性。例如,在CRC的临床前模型中,已经显示FMT可以减轻基于5-氟尿嘧啶的化疗的不良事件。在临床前模型中,FMT和吲哚3-丙酸(一种具有细胞内信号活性的微生物代谢产物)均已被证明可防止辐射相关的毒性和双歧杆菌给药与降低CTLA-4相关的肠毒性相关。
超越细菌
尽管迄今为止许多研究集中于与反应和毒性相关的细菌分类群,但是其他微生物(例如,病毒/噬菌体和真菌)也是需要考虑的。这将需要整合宏基因组测序方法,因为传统的微生物组分析依赖于对细菌特有的16S核糖体RNA (rRNA)进行测序。宏基因组测序可能有助于鉴定与反应相关的其他几种微生物,并且还可以补充额外的功能评估。这些方法可能会发现新的关键机制,从而为针对这些微生物的功能的未来策略提供信息。目前,缺乏样品制备、测序、数据处理和分析的标准化方法带来了巨大的挑战,需要在未来的工作中加以解决。尽管存在这些挑战,肠道微生物的特征分析和靶向几乎肯定会成为未来十年个性化医疗和健康方法的一部分。
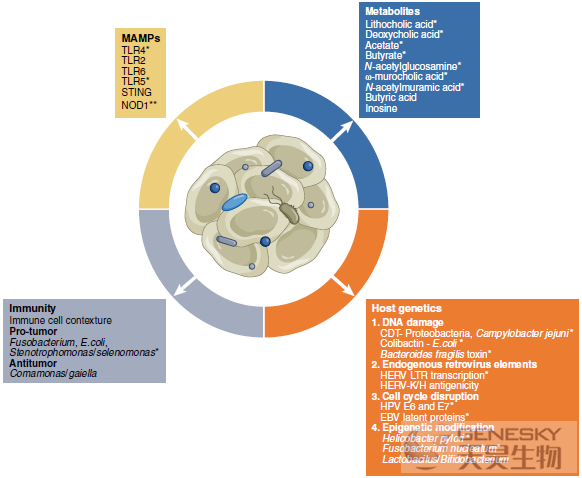
在各种肿瘤类型中,TME的表征导致了对每种癌症类型的不同肿瘤内微生物组的检测。肿瘤内微生物通常在TME的癌细胞、基质细胞和免疫细胞内定居。有趣的是,研究已经阐明了肿瘤内微生物驱动癌发生的几种机制。
首先,组织驻留微生物可能通过改变宿主基因组的各个方面来促进肿瘤发生。例如,组织常驻细菌可以通过它们表达的基因毒素直接诱导DNA损伤。值得注意的是,表达大肠杆菌素的大肠杆菌和表达细胞致死性膨胀毒素的前肠杆菌和空肠弯曲杆菌,诱导双链DNA断裂,而菌株如嗜银双孢菌、具核镰孢菌和脱硫脱硫脱硫弧菌通过产生活性氧诱导DNA氧化应激。除了直接诱导DNA损伤外,组织常驻微生物如表达EspF的大肠杆菌和幽门螺杆菌能破坏DNA错配修复机制,进一步加剧基因组不稳定性并驱动肿瘤发生。细胞周期也可以被组织驻留病毒直接破坏以促进肿瘤发生,如人乳头瘤病毒(人乳头瘤病毒)和EB病毒(EBV)驱动恶性肿瘤。微生物(以及它们的残余物,如在内源性逆转录病毒的情况下)也已被证明通过与宿主基因组相关机制驱动肿瘤发生,例如通过改变局部表观遗传景观或者宿主转录。
第二,基于组织的微生物可以通过在组织内诱导促肿瘤发生的炎性环境来促进肿瘤形成,如产肠毒素类杆菌、具核镰孢、大肠杆菌和寡养单胞菌/硒单胞菌产生能够引发炎症反应并募集免疫亚群的毒素,这些免疫亚群共同导致局部组织的过度增殖。在结肠细胞中,产肠毒素类杆菌毒素启动STAT3核因子-κB (NFkB)依赖性促炎信号级联反应,产生细胞因子,如白细胞介素(IL)-17和IL-23,这已被证明可募集前肿瘤髓样细胞。此外,幽门螺杆菌通过其细胞毒素相关基因A (CagA)的表达促进胃组织中的过度增殖性炎症,而具核梭状芽孢杆菌通过表达FadA蛋白在结肠直肠组织中获得了相同的表型。选择微生物相关的分子模式(MAMPs)也显示促进肿瘤发生。例如,在化学诱导的皮肤癌模型中,骨髓来源的白细胞中鞭毛蛋白依赖性Toll样受体(TLR) 5的激活增强了致癌作用。微生物对肿瘤发展的影响也不仅限于细菌。由特定微环境中的真菌成分组成的真菌群落与胰腺导管腺癌(PDA)的发展有关。真菌的迁移,特别是马拉色菌。从肠道到胰腺,通过甘露糖结合凝集素激活补体促进PDA发育。
最后,微生物代谢的副产品也可能导致致癌。次生代谢物,如次生胆汁酸石胆酸和脱氧胆酸和分解代谢物,如乙酸盐和丁酸盐在几种癌症模型中,每一种都通过增强上皮-间质转化和/或细胞增殖而发挥致癌作用。脱氧胆酸与结直肠癌、肝细胞癌和食管癌有关,它的产生水平随着高脂肪饮食而增加,这进一步为某些高风险饮食与消化道癌症发展的关联提供了基础。
除了在一些组织类型的肿瘤发生中起作用之外,基于组织的微生物还可以通过改变局部细胞因子和免疫细胞谱来影响已发展的癌症病变内的免疫景观。然而,必须注意的是,这些效应是高度依赖于环境的,因为不同的微生物已经显示出极化不同类型的局部免疫反应,其可以促进或抑制肿瘤生长。
在许多情况下,肿瘤内微生物通过促进耐受性免疫来驱动肿瘤进展。首先,微生物可以通过模式识别受体的有条件激活来实现这一点。例如,在TME的癌细胞和免疫细胞中都发现了细菌脂多糖可以与浸润单核细胞上的TLR4结合,使其向免疫抑制型M2表型分化,并且还作用于肿瘤细胞以促进CD11b+Gr1+髓源性抑制细胞和CD1d+CD5+调节性B细胞的募集,这可以共同抑制局部抗肿瘤T细胞反应。此外,在CRC中,微生物肽聚糖对NOD1的激活已被证明以精氨酸酶1依赖的方式诱导髓源性抑制细胞驱动的免疫抑制。
肿瘤内微生物也可以通过改变局部细胞因子环境或上调肿瘤细胞上的免疫调节配体来介导免疫抑制。在PDA,变形菌通过上调免疫调节细胞因子如IL-10来促进免疫逃避,从而降低干扰素(IFN)-γ+1型辅助性T细胞的极化。此外,最近的研究表明,在病毒介导的肿瘤中,涉及PD-1和CTLA-4的免疫调节通路上调。例如,在头颈部鳞状细胞癌(HNSCC)中,已经显示人乳头瘤病毒整合上调编码PD-L1 (CD274)和PD-L2 (PDCD1LG2)基因的表达,导致抗肿瘤免疫反应的抑制。
另一方面,肿瘤内微生物也可能支持抗肿瘤免疫。肿瘤内TLR2、TLR6、STING和NOD1的激活已经证明了对癌性病变的增强和有效的免疫监视。最近的证据还表明,微生物可以作为局部淋巴细胞活化的焦点,导致在TME内形成高度治疗性的三级淋巴结构(TLSs)。在CRC的小鼠模型中,实验性的肝螺杆菌(Hhep)通过诱导典型的TLS来降低肿瘤负荷。引人注目的是,这些典型的TLS具有Hhep和Hhep特异性滤泡辅助性T细胞,提示瘤内Hhep是TLS衍生的抗肿瘤免疫的焦点。与人乳头瘤病毒阴性的HNSCC相比,微生物相关的癌症,如人乳头瘤病毒阳性的HNSCC,其特点是生存期延长,TLS频率增加,B细胞活性增强。来自TLS相关肿瘤浸润B细胞的抗体也显示对人乳头瘤病毒蛋白E2、E6和E7的识别增强。此外还发现微生物肽存在于黑素瘤肿瘤细胞的表面,并被T细胞识别。总之,这些结果表明,肿瘤内微生物抗原可在TME内发现,并可诱导强烈的局部免疫反应,特别是在TLS内,在TLS内可引发高度治疗性和交叉功能性免疫。
考虑到它们在形成免疫和其他生理过程中的整体作用,人们可以预见,通过靶向重建来操纵肠道和组织驻留/肿瘤驻留微生物群的干预策略,和/或通过施用微生物衍生产品来增强当前的治疗,将成为癌症治疗的整体部分——有朝一日演变为癌症治疗的主要支柱。现在有几种策略可以用来靶向肠道和肿瘤微生物,包括但不限于FMT、使用单一菌株或设计者群体的靶向微生物策略、基于饮食和益生元、基于益生菌和益生元的干预、靶向抗生素方法和基于噬菌体的方法。在癌症患者中研究这些方法的许多临床试验现在正在进行和/或已经完成,并且重复这些方法以治疗、拦截和最终完全预防癌症的不同策略和机会将在下面讨论。
也许FMT是最激烈、但也是最有效的调节肠道微生物群的方法之一——它是将来自供体(通常是健康个体或对治疗有特殊反应的人)的整个肠道微生物群移植到受体体内,如癌症患者。这种方法已经成功地逆转了对ICB治疗的耐药性;最近在转移性黑色素瘤患者中进行的两项关键研究表明,从对ICB治疗完全有效的患者到耐药患者的FMT与这些患者的ICB耐药逆转相关。在这些研究中,供体微生物群在受体肠道中的成功定殖增加了受体肠道中细菌(如乳球菌科和双歧杆菌科)的丰度,这些变化与改善的临床反应相关。此外,FMT后这种反应的改善表现为接受治疗的患者肿瘤和肠道中免疫浸润的增强,以及特定治疗相关血清代谢物的富集。鉴于这些发现,目前正在进行严格的研究工作,以确定癌症试验中理想的FMT供体是通过免疫疗法成功消除癌症的患者,还是从未患过癌症的高度健康的个体而来。来自完全缓解供体和/或健康供体的结合ICB治疗和FMT的其他试验目前正在进行中,并展示了有希望的早期结果。
FMT的临床相关性还扩展到了ICB治疗之外,并改善了其他治疗应用。在临床试验中,早期I期研究的初步结果已经确定FMT是一种有前途的治疗类固醇难治性胃肠道移植物抗宿主病(造血干细胞移植治疗白血病的并发症)的方法,其中FMT受体表现出较大的移植物抗宿主病临床缓解。因此,FMT作为一种缓解治疗相关毒性的方法,也正在几项临床试验中进行探索。应该注意的是,FMT试验经历了几个挑战(例如确定合适的FMT供体、确定移植前的最佳准备方案、剂量和给药途径等),尽管这些试验的结果正被用来指导更有效的下一代微生物策略的开发。
确定的微生物群落和益生菌
虽然FMT方法涉及整个供体微生物群的移植,但最近调节肠道微生物群的努力集中在单一微生物物种和/或设计微生物群落的特异性移植,以增强对ICB和其他形式的癌症治疗的反应。早期结果显示展示了一些成功的证据。例如,在一项小型开放试验中,接受CBM588(一种包含丁酸梭菌菌株的制剂)联合ICB治疗的转移性肾细胞癌(RCC)患者中有58%对治疗有反应,相比之下,仅接受ICB治疗的患者中有20%有反应。此外,接受CBM588治疗的患者的PFS显著增加至12.7个月,相比之下,仅ICB治疗的只有2.5个月。由此强调了添加双歧杆菌产品可以增强RCC患者的临床结果。类似地,几个产生假说的临床前和临床研究表明粘蛋白阿克尔曼菌菌株、双歧杆菌、鸡肠球菌或多个共生菌株的组合也有相似效果,但需要进一步的临床评估。
然而,尽管CBM588取得了上述早期成功,这种整体方法的可行性和功效仍有待确定。事实上,目前正在进行几项试验来评估微生物群落或靶向微生物策略与当前癌症疗法的结合,人们急切地等待着这些试验的结果。尽管如此,这些方法在非癌症适应症如艰难梭菌结肠炎中表现出显著的疗效,并且在优化癌症治疗中的肠道微生物群调节的长期努力中,预期比FMT具有明显的优势。
此外研究者还测试了基于益生菌的治疗方法,但在考虑将其与ICB(和其他疗法)一起用于癌症患者的治疗时应当谨慎。最近的证据表明,在临床前癌症模型和用ICB治疗的人类癌症队列中,使用市售益生菌与更差的结果相关。尽管如此,开发“下一代”益生菌仍有巨大的机会,因为最近的研究表明,肠道中的特定微生物可能会增强抗肿瘤免疫反应——部分是通过在TME中诱导高度治疗性的TLS,这与各种癌症类型的患者对ICB的反应有利相关。总之,这些研究路线为移植和靶向特定治疗微生物以增强癌症治疗、拦截和预防中的抗肿瘤免疫开辟了新的可能性。
靶向抗生素、基于噬菌体、小分子和基于CRISPR的策略
如前所述,广谱抗生素的使用和肠道微生物群的大规模破坏与ICB 和其他疗法的更差结果相关。然而,针对潜在有害或致病微生物的精心选择的抗生素疗法——同时促进有益微生物的扩增可能会促进宿主的有利反应。根据这些思路,已经提出使用CRISPR-Cas 9编码噬菌体选择性去除特定疾病相关分类群,其在癌症治疗中的应用前景仍处于起步阶段。此外,还开发了小分子方法来调节肠道微生物的组成和功能,这些策略避免了与微生物群落的规模化生产和对患者熟练施用这些活生物治疗剂相关的一些复杂性。这些方法已成功应用于动脉粥样硬化的临床前模型,通过施用小分子肽靶向重塑肠道微生物群与降低总胆固醇、减少动脉粥样硬化斑块和减少促炎细胞因子如IL-6、肿瘤坏死因子等。这些类型的方法预计将在未来几年内扩展,并将随着我们在这一领域的前进而极大地塑造治疗学的景观。
饮食和益生元策略
除了上述直接调节肠道微生物群的策略外,饮食也是调节微生物组成和功能的重要手段。虽然在过去的几十年中,饮食和饮食干预的作用已经在癌症的背景下进行了广泛的研究,但是由于缺乏严格的程序标准化和饮食与观察到的临床效应之间的相关关系而非因果关系的报道,因此存在局限性。然而,来自临床前研究的有力证据表明,许多饮食策略,包括长期热量限制、短期禁食、生酮饮食(或口服补充酮体3-羟基丁酸盐)、高纤维饮食和口服特定微量营养素,可能在免疫治疗中改善抗癌免疫监测。此外,多项临床研究评估了癌症患者的饮食干预,并成功纳入了饮食建议,旨在使用FMT和其他策略的临床试验中调节肠道微生物群。这些研究是至关重要的,因为这代表了在其他微生物靶向策略或其他癌症治疗中调节肠道微生物功能的易处理策略。已经有证据表明,在临床前模型中,高纤维饮食与ICB临床结果改善相关。当然,这代表了一种可以由患者自身主动调节的可修改的宿主因子,尽管当我们将这种饮食变化整合到癌症护理的结构中时,来自医生的关键指导和数据驱动的方法来监控和支持患者的依从性是至关重要的。
除了改变饮食本身,还有大量的机会来整合益生元的使用。益生元是化学上不易消化的纤维,如菊粉或菊粉丙酸酯,在临床前模型中,它们已被证明会影响肠道微生物的功能状态。例如,多酚补充剂与丁酸盐产量增加以及双歧杆菌和乳酸菌数量增加有关。然而,值得注意的是,这些益生元的效果很大程度上取决于肠道中存在的细菌种群,例如,普雷沃菌属占优势的微生物组和拟杆菌属占优势的微生物组之间的碳水化合物发酵不同。尽管如此,通过调节细菌代谢产物的产生和改变微生物生态系统,生物制剂有可能以多种方式调节生理机能——所有这些都可以用于治疗。
涉及基于组织和肿瘤的微生物治疗策略
通过将微生物直接引入癌性病变来治疗癌症的想法已经存在了一个多世纪,并且发现了在发生感染的癌症患者中肿瘤消退的现象。一个世纪后,通过使用微生物菌株治疗癌症的努力正在进行中。几种微生物制剂,如野生型或修饰的活病毒,具有选择性溶解癌细胞能力和经修饰的细菌,已经在临床试验中使用,并且在许多癌症环境中显示出有希望的抗肿瘤效果。改良细菌也被证明是有效的。一些实例强调了微生物制剂在治疗现有肿瘤中的潜在功效。其他策略旨在预防癌症例如针对癌症相关感染因子(包括EBV和人乳头瘤病毒)的疫苗接种。令人鼓舞的发现证明了设计的微生物剂的有效性,这使得它们能够准确地靶向肿瘤细胞或TME,这可以作为开发未来疗法的基础,其中基于微生物的疗法或疫苗不仅产生局部肿瘤治疗,而且产生针对转移性疾病的全身性保护。此外,在癌症类型中识别和验证统一的、与治疗相关的肿瘤内信号可以加速广泛可用的现成癌症治疗方法的发展。
随着微生物群作为健康和疾病的重要驱动因素的出现,现在有一个独特的机会将肠道和其他小生境中微生物群的分布和靶向整合到精确癌症护理中(图4)。目前,个性化癌症护理通过靶向基因分型或NGS方法,将癌前或癌性组织的组织病理学特征谱(由病理学家目测)与基因组或蛋白质组变化谱(如RAS、MSH/MLH和HER-2)结合起来,以及在基线和治疗期间的有限免疫细胞谱(PD-L1、CD8和其他标记物),以帮助指导治疗和评估反应。在不久的将来,通过对肿瘤来源的循环无细胞DNA的非侵入性询问,有可能分析某些标记物。
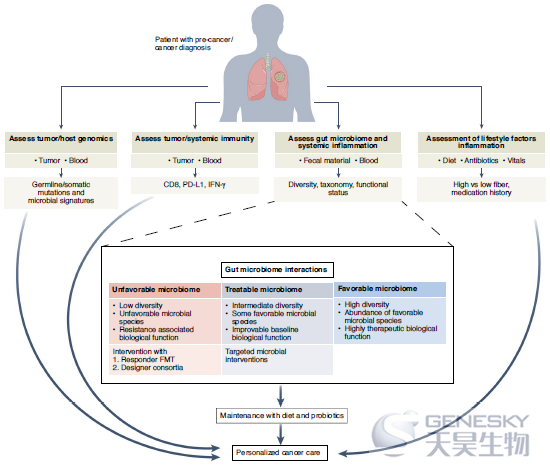
尽管包括将微生物群的评估作为反应的生物标志甚至作为治疗目标正在增加,目前针对肠道、组织/肿瘤和其他小生境(包括基于血液的微生物特征)中的微生物群的图谱分析仅在研究的背景下进行。正在探索全身炎症标记物(如C-反应蛋白和IL-6)和全身免疫标记物(如中性粒细胞与淋巴细胞比率)的评估,但不是当前临床标准的一部分。此外,评估在考虑癌症前期、癌症和其他疾病状态的治疗时,饮食模式和其他生活方式因素(如睡眠和压力)并未始终如一地纳入其中。然而,现在出现了一些策略采用更全面的方法来预防和治疗-癌症治疗,有机会通过多方面的监测、反馈和早期干预来促进健康。当然,在未来的5到10年里,人们可以设想一种更全面的方法来护理癌症患者。其中包括组织/肿瘤和血液的评估超越目前的标记,有机会针对新的免疫机制,通过改善免疫监测来预防和治疗癌症。此外,随着我们转向更全面的癌症和其他疾病治疗方法,肠道(和潜在的其他生态位)中微生物群的分布图谱具有很大的前景,正如对全身炎症标记物(超越目前的标记物)的分析以及对生活方式和其他因素的评估一样。这种策略将通过使用新兴的技术进步得到极大的促进,例如人造芯片肠道模型、可穿戴技术、用于微生物组采样的可摄取胶囊、代谢组学分析和智能马桶等。此外,通过人工智能整合多组学数据将为通过数学建模和其他方法改进处理、拦截和预防策略提供机会,同时迭代和构建当前关注肠道微生物群的方法,具有明显菌群失调特征的个体,其特征为低多样性和大量“不利”和/或功能状态差的病原微生物,可能从FMT或完整的设计者联盟等综合干预中获得最佳益处。相比之下,具有中度肠道菌群失调的个体,以中等多样性和一些功能状态相对保存的有利物种为特征,可能从目标微生物干预中受益,而具有有利微生物的个体不太可能从这种干预中受益,应该通过饮食干预来支持(应该在所有治疗组中一致实施)。与其他策略一起,上述方法将导致更优化的个性化癌症护理和改善的精确健康。
在过去十年中,我们对宿主微生物在正常生理和疾病中的作用的理解有了显著的发展,揭示了针对肠道和其他小生境中的微生物来治疗疾病并最终促进整体健康的机会。然而,该领域还处于起步阶段,有很大的机会进一步阐明这些微生物影响生理和病理过程的机制,以及通过饮食干预和其他方法靶向它们的最佳方法。虽然挑战仍然存在,但我们预计在未来5到10年内,肠道和其他小生境中微生物群的分布和靶向将成为综合癌症护理以及其他疾病管理的一部分。
天昊生物微生物测序相关链接:
开工大吉,好文读起!《Microbiome》宏基因组 + RNA-seq + 代谢组联合分析揭示糖尿病患者饮食与菌群及免疫关系;
祝贺!天昊微生物扩增子和基因组学联合分析助力客户骨质疏松研究见刊一区杂志《Frontiers in Microbiology》;
祝贺!天昊客户利用16S扩增子测序研究杏鲍菇多糖发酵特性,文章登陆食品科学领域一区期刊《Food Chemistry》;

创新基因科技,成就科学梦想