
 咨询热线:400-065-6886
咨询热线:400-065-6886

 咨询热线:400-065-6886
咨询热线:400-065-6886
1925年,5-甲基胞嘧啶首次在细菌中被报道。然而,几十年来,它的生物学重要性并不清楚。在最初的停滞之后,这种甲基化的碱基在生命的所有领域普遍存在,并显示出一系列基本的生物学功能。时至今日,我们已经掌握了建立、维持和去除DNA甲基化的关键因素的知识,并已经获得数量惊人且快速增长的碱基分辨率的甲基化图谱。尽管如此,关于DNA甲基化模式的精确作用和解释的一些基本细节仍在研究中。


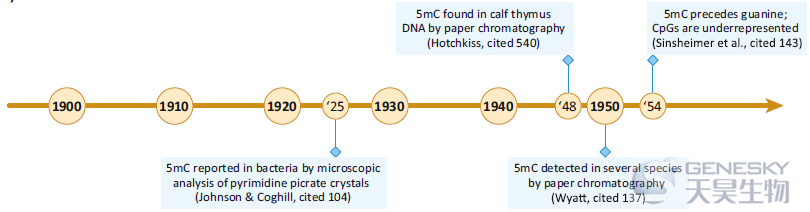
20世纪之交,Walter Sutton(1902)和Theodore Boveri(1903)各自提出了遗传染色体理论,将孟德尔(1866)长期被忽视的基因行为和遗传规律与他们自己的减数分裂研究联系起来。这一最初有争议的理论在1910年的一篇论文之后得到了它的一位批评者的信任,即Thomas Hunt Morgan,其证明了黑腹果蝇的眼睛颜色是由X染色体上的基因遗传决定的,为支持这一理论提供了第一个决定性证据。Levene和Jacobs对核酸的研究表明,它们位于核苷酸的聚合物链中,对这些核酸组成的日益浓厚的兴趣为表观遗传学领域奠定了基础,其中DNA甲基化是一个核心角色。
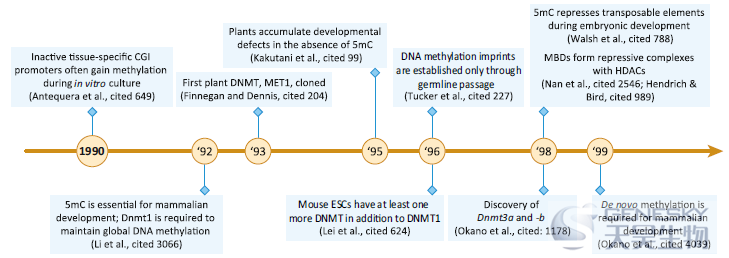
【5mC在活细胞中的发现】这一时期内,多项研究在不同的物种和细胞中首次发现了5-甲基胞嘧啶,包括结核分枝杆菌(1925)、小牛胸腺(1948)、哺乳动物/昆虫/植物(1950)。1953年DNA双螺旋结构被报道之后,Sinsheimer在1954年发现5mC在DNA中不是随机分布的,而是在CpG二核苷酸中特异分布的。
【总结】为什么从最初的生物学发现到对5mC的研究进展如此之快要经过这么长的时间?一个显而易见的原因是它被发现的历史背景。1925年,我们还不知道核酸聚合物链携带遗传信息。1928年由Frederick Griffith转换实验、1944年的Avery-MacLeod-McCarty实验、第二次世界大战的结束、1952年Hershey-Chase实验和DNA双螺旋结构的发现帮助奠定必要的基础,使5mC在DNA中可能的相关性的探索变为现实。另外两个因素可能引起了一些最初的犹豫:其他组在他们的结核分枝杆菌DNA分离株中没有发现5mC,而Hotchkiss和Wyatt报道的5mC的低丰度似乎不符合5mC具有主要生物学功能的条件。另外,值得一提的是,在这些实验进展的同时,发育生物学家Conrad Waddington在1942年创造了“epigenetics”(表观遗传学)这个词,并于1957年发表了他广泛使用的表观遗传学图谱。然而,这些概念并没有与DNA甲基化联系起来,直到它的功能在随后的几十年变得更加清晰。

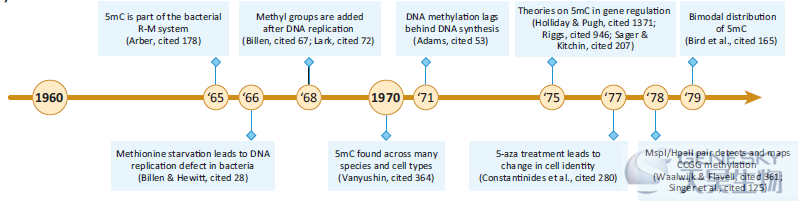
分子生物学为从植物到哺乳动物的DNA甲基化研究奠定了基础。然而,对细菌中核酸甲基化的研究首先取得了重要进展。作为一种易于控制和丰富的模式生物,细菌为原核生物中的5mC生物学提供了重要的见解,从而为其在高等生物中的研究铺平了道路。
【细菌限制和修饰系统】这一时期内,Arber提出了限制和修饰系统(R-M系统),甲基化敏感的“限制酶”通过消化病毒的DNA来保护宿主免受病毒的入侵。细菌DNA免受这些限制酶的影响,因为它们的DNA以物种特异性DNA甲基化的形式发生修饰(1965)。
【细菌DNA复制中发生甲基化】Billen等人在细菌中发现DNA复制后甲基基团被添加到新生的DNA链上(1968)。
【大鼠组织中5mC和甲基转移酶活性】同样在1968年,胚胎和成年大鼠不同组织的核提取物中发现DNA甲基转移酶活性。
【总结】DNA甲基化的第一个生物学作用来自于对细菌免疫和DNA复制基础的研究,尽管尚不清楚这些功能是否会在高等生物中保守。一个关键的进展是基于酶在核酸聚合物中负责将甲基基团添加到胞嘧啶的发现。这表明DNA甲基化可以被调控,从而为特异性靶点修饰提供了途径。特别是,5mC在啮齿类动物中可能的组织特异性作用很有趣,但数据太少,还不能得出更有意义的结论。

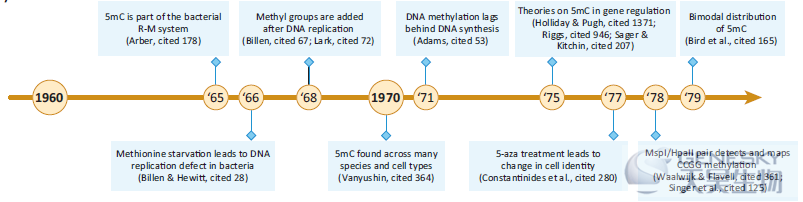
一旦人们了解到,尽管5mC的含量相对较低,但它在细菌中确实具有生物学功能,DNA甲基化也可能在跨物种中发挥更普遍的调控作用的可能性就变得可信了。同许多领域一样,需要取得重要的技术进步,才能对这十年中出现的理论模型进行全面和详实的研究。
【更广泛的DNA甲基化定量】20世纪70年代初,Vanyushin对许多动物的不同细胞类型中存在的5mC水平进行了定量,包括海绵、软体动物、海胆、硬骨鱼、两栖动物、爬行动物和哺乳动物。
【DNA甲基化在基因表达中的作用】随着质谱甲基化分析报道的增多,一些研究小组推测5mC在高等生物中的可能作用,包括:(i)5mC可能在真核生物发育中不发挥作用;(ii)5mC可能引导DNA突变,当时被认为是转录变化所必需的;(iii)5mC可能作为转录激活因子。1975年,分别发表了三篇值得注意的综述,均为思考和研究DNA甲基化的生物学效应提供了独特的框架。虽然每一篇综述在其具体的、合理的机制上都有所不同,但他们都基本同意,5mC将在调节基因表达和协调发育方面发挥作用。
【5-aza和甲基化缺失】20世纪70年代末,一种名为5-aza(5-氮杂胞苷)的化合物的研究与DNA甲基化领域发生了交叉,并最终为该领域提供了另一个重要的工具。5-aza是一种胞嘧啶核苷类似物,可结合到DNA和RNA中,在20世纪60年代末和70年代初被广泛用作诱变剂和抗癌药物。Friedman发现5-aza对大肠杆菌的处理降低了5mC而不是6mA水平,这表明除了其诱变特性,5-aza可能是5mC甲基转移酶的特异性抑制剂。一年后,Jones和Taylor将这些发现扩展到真核生物,报道5-aza降低了5mC,并推测它可能阻碍了沿着DNA的可能是进行性的甲基转移酶活性的进展。
【总结】20世纪70年代,关于DNA甲基化在基因调控中的作用的研究和假设模型都取得了显著进展。改进的5mC检测方法支持特定位点的甲基化分析,是该领域的主要加速器。对这些早期论文的仔细阅读揭示了需要强调的其他要点,包括无脊椎动物和脊椎动物之间基因组甲基化的整体差异,尽管其他结果如脊椎动物精子的低甲基化在其他人重复时并不正确。在这个十年结束时,该领域对物种内部和跨物种的DNA甲基化有了良好的评价,DNA甲基化作为基因表达的抑制因子已被普遍接受。

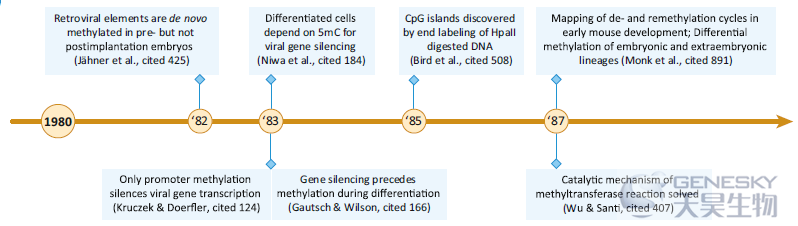
20世纪70年代中期至80年代中期,在体外和体内克隆以及转基因技术方面取得的一些进展使一系列新的实验得以探索DNA甲基化的序列信息和功能作用。例如,将未甲基化和甲基化的DNA结构插入活细胞的可能性是这十年许多研究的基础。
【CpG岛(CGIs)的发现】虽然精子总体上高度甲基化,但在精子细胞中也可以看到类似于早期后生动物胚胎中发现的低甲基化延伸,这些延伸在组成性表达基因中也存在。Bird和同事随后发现,这些未甲基化的区域由富含CpG的DNA组成,并且在许多小鼠组织中都保持未甲基化。由于其对HpaII核酸酶消化的敏感性,最初被命名为HpaII微小片段,后来被推广为CGIs。
【第一个DNA甲基转移酶克隆】细菌甲基转移酶的克隆和蛋白测序为了解其催化结构域的进化保守性和功能提供了重要的线索。特别是对细菌酶M.HhaI的研究,阐明了甲基转移反应的化学性质,以及细菌甲基转移酶序列特异性的酶学研究。基于这一势头,一系列从哺乳动物组织中纯化和鉴定DNA甲基转移酶活性的研究导致Bestor及其同事在1988年成功克隆了鼠DNA甲基转移酶1(Dnmt1),这是首个哺乳动物DNA甲基转移酶。
【总结】20世纪80年代对DNA甲基化的总体分布和功能提供了重要的见解,包括CGIs的发现和对5mC在基因调控中的作用的进一步理解。十几种细菌和首个哺乳动物甲基转移酶的成功克隆和鉴定代表了另一个里程碑。尽管普遍的共识是5’启动子甲基化抑制转录,但这一规律的一些例外强调,仍需要进一步的研究来理解和解释DNA甲基化在特定环境中的作用。尽管在哺乳动物系统中有这些关键的进展,但值得注意的是,当时的主导模式生物包括酿酒酵母、果蝇和秀丽隐杆线虫,它们没有DNA甲基化,这可能解释了对5mC具有更广泛意义的一些遗留的担忧。


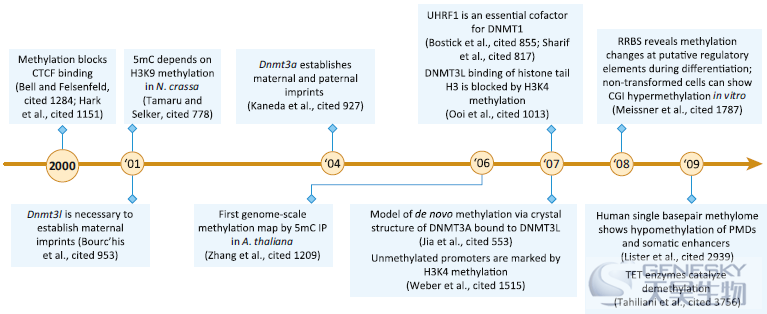

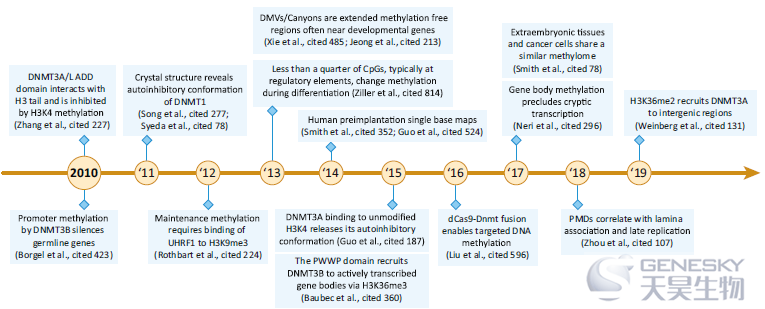
在过去的几年中,已经发表了几篇全面的综述,涵盖了近十年来的最新发现。为了补充这一点,我们选择了一些实验进展进一步扩展了5mC的基本原理及其在基因组调控中的作用。测序技术的灵敏度、通量和可负担性的提高使一系列新的图谱研究成为可能,这些研究为许多新的见解提供了基础。
【DNA甲基化和转录因子(TFs)的相互作用】随着不同细胞类型的DNA甲基化组的分辨率不断提高,人们发现低甲基化的CpGs通常集中在与CGIs不重叠的短的区域。Schübeler及其同事对小鼠ESC和神经祖细胞中的低甲基化区域(LMRs)进行了更深入的研究,发现它们约占所有CpGs的4%,甲基化水平介于10%到50%之间。大多数LMRs在分化过程中丢失或重新获得,并富集各自细胞类型中表达的转录因子基序。早期研究表明,DNA甲基化直接影响单个TFs的结合。然而,DNA甲基化也改变了染色质的结构和可及性,这反过来可能影响TF的结合。计算预测表明,5mC对DNA形状有显著影响,这可能影响TF对目标序列的接近。为了量化这一效应,高通量体外筛选技术被开发出来,发现90%的研究中含有CpG基序的转录因子的亲和性受到DNA甲基化的影响,但只有很少的研究进一步在体内证明了这一点。
【重新的DNMTs的招募和靶向】与H3K4甲基化的屏蔽作用相反,一些研究发现H3K36的甲基化会招募DNMTs。2010年,发现重新的甲基转移酶中保守的PWWP结构域在体外与H3K36二甲基化和三甲基化相互作用,这种相互作用是DNMT3A在人类细胞中正确定位所必需的。几年后,Schübeler实验室发现,DNMT3A和B通常都被招募到CpG密集区域,而DNMT3B则通过其PWWP域与H3K36me3相互作用,被特别招募到转录活跃的基因体内。Weinberg和他的同事随后发现DNMT3A被H3K36me2特异地招募到基因间区域。从小鼠ESCs中移除H3K36me2,将DNMT3A重新分配与H3K36me3标记区域结合。另一项研究报道,H3K36甲基转移酶、NSD1和SETD2在小鼠雄性和雌性生殖细胞的DNA甲基化图谱形成中发挥关键作用。这些研究表明,除非受到H3K4甲基化的保护,否则从头开始的甲基转移酶通常结合CpG丰富的区域,而H3K36甲基化将重新的DNMTs招募到额外的靶点,如积极转录的基因体。
随着基于Cas9的基因编辑工具的出现,Cas9识别特定基因组序列的能力被用来构建各种调控因子的靶向招募工具。第一代表观编辑工具包括催化失活的Cas9(dCas9)和DNMT3A或TET1的催化结构域的融合蛋白。这些系统旨在通过甲基化或去甲基化报告基因的启动子来控制它们的转录。使用SunTag系统将多个DNMT3A或TET1单元与dCas9融合,进一步提高了效率。然而,正如预期的那样,观察到了广泛的脱靶效应,需要进一步提高靶向特异性才能将催化活性限制在预期的靶点上。
【发育和疾病中整体甲基化变化】对5mC进行更全面的映射,改善了对高甲基化域(HMDs)和部分甲基化域(PMDs)的独特整体结构的描述。虽然PMDs可以在大多数健康细胞类型中检测到,但衰老、癌变和胚胎外组织中PMDs的甲基化水平均进一步降低。Zhou等人认为PMD的低甲基化程度与有丝分裂细胞的分裂次数有关。这些晚期复制区域的不完全甲基化可能导致生物生命过程中DNA甲基化的持续缺失,这一过程可能在肿瘤发展和进展过程中加速。
如前所述,早期胚胎外谱系和胎盘以及体细胞癌症,都有PMD甲基化的减少,但也表现出与H3K27me3抑制发育基因重叠的CpG丰富的结构域的特定甲基化获得,这些通常位于DNA甲基化谷(DMVs)中。一旦DNA甲基化图谱在早期外胚层中建立,甲基化在大多数情况下都是静态的,除了启动子区域外的CpGs集在分化过程中显示动态的甲基化变化。
【总结】利用测序技术绘制来自不同生物体的数百种细胞类型和发育阶段的甲基化组,对过去几十年的研究有了完善的见解,填补了一些重要的知识空白,并提供了5mC分布和动态的全面概述。结合结构研究,这导致了对DNMTs的招募和活性以及DNA甲基化对基因调控的影响的详细了解。其中一些基因是如何被机械翻译的,以及它在基因组的其他部分起什么作用,仍有待探索。


创新基因科技,成就科学梦想