
 咨询热线:400-065-6886
咨询热线:400-065-6886

 咨询热线:400-065-6886
咨询热线:400-065-6886
新陈代谢、睡眠模式、身体成分和激素状态的改变都是衰老的关键特征。虽然下丘脑是一个保守性较好的大脑区域,控制着这些自我平衡和生存相关的行为,但人们对下丘脑衰老的内在特征知之甚少。2022年7月4日,布朗大学Webb团队于Nature Aging杂志在线发表了最新研究成果“Single-cell analysis of the aging female mouse hypothalamus”,利用单细胞RNA测序技术分析了衰老雌性小鼠下丘脑。
该研究对年轻和老年雌性小鼠的40,064个下丘脑细胞核进行了单核RNA测序(snRNA-seq)。团队在神经元亚型、星形胶质细胞和小胶质细胞中发现了衰老的细胞类型特异性特征。发现了对代谢调节和身体组成至关重要的细胞类型的变化,以及下丘脑与认知有关的一个区域。这一研究还揭示了下丘脑衰老中一个意外的雌性特异性特征:X失活的主要调节因子Xist随着年龄的增长而升高,尤其是在下丘脑神经元中。此外,利用机器学习,作者展示了X染色体基因和Xist本身的水平可以准确预测细胞年龄。这项研究确定了哺乳动物下丘脑衰老的关键细胞特异性变化,并揭示了雌性神经元衰老的潜在标志。

主要研究结果
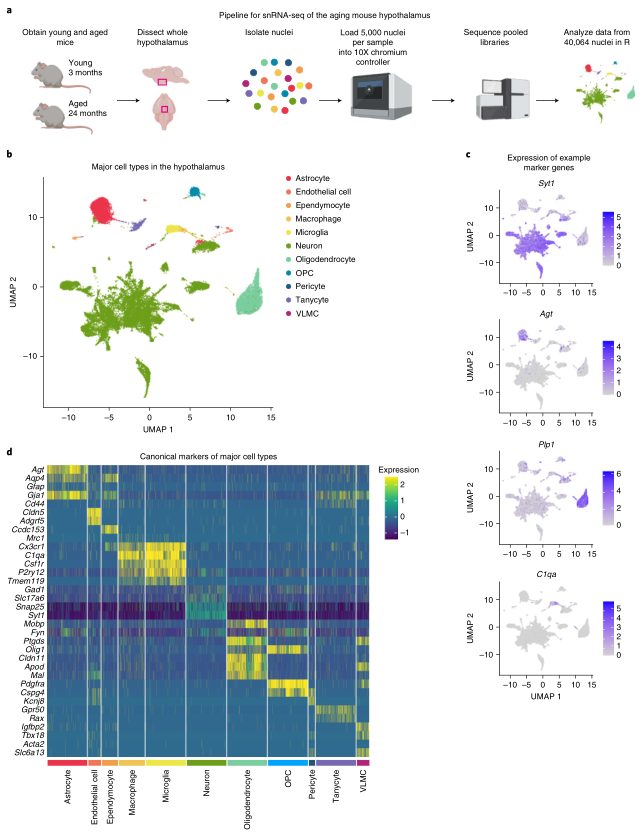
作者从幼龄(3个月)和衰老(19-24个月)雌性小鼠下丘脑中分离细胞核进行单细胞核RNA测序,每个年龄有4个生物学重复(图1a)。在质控后,有40,064个高质量的细胞核进行后续分析。基于公认的标记基因识别了下丘脑中主要的细胞类型(图1b-d),包括星型胶质细胞、内皮细胞、室管膜细胞、巨噬细胞、小胶质细胞、神经元、少突胶质细胞、少突胶质前体细胞(OPC)、周细胞、伸长细胞和血管柔脑膜细胞(VLMC)。
为了研究下丘脑中衰老相关的基因表达动态,首先利用单细胞转录组基于模型分析的方法(MAST)对所有细胞进行差异表达分析,发现了与衰老相关的275个上调和342个下调的基因(图2a),并且利用公共芯片数据进行了初步验证。接下来,对每种主要细胞类型也进行了差异表达分析(图2b),变异系数分析也发现年龄间主要细胞类型差异显著,几乎所有细胞类型均随年龄增加而增加(图2c)。利用基因集富集分析(GSEA)分析了不同细胞类型中衰老影响的细胞过程,观察到每种细胞类型中独特的衰老特征,以及一些共同的衰老特征(图2d)。
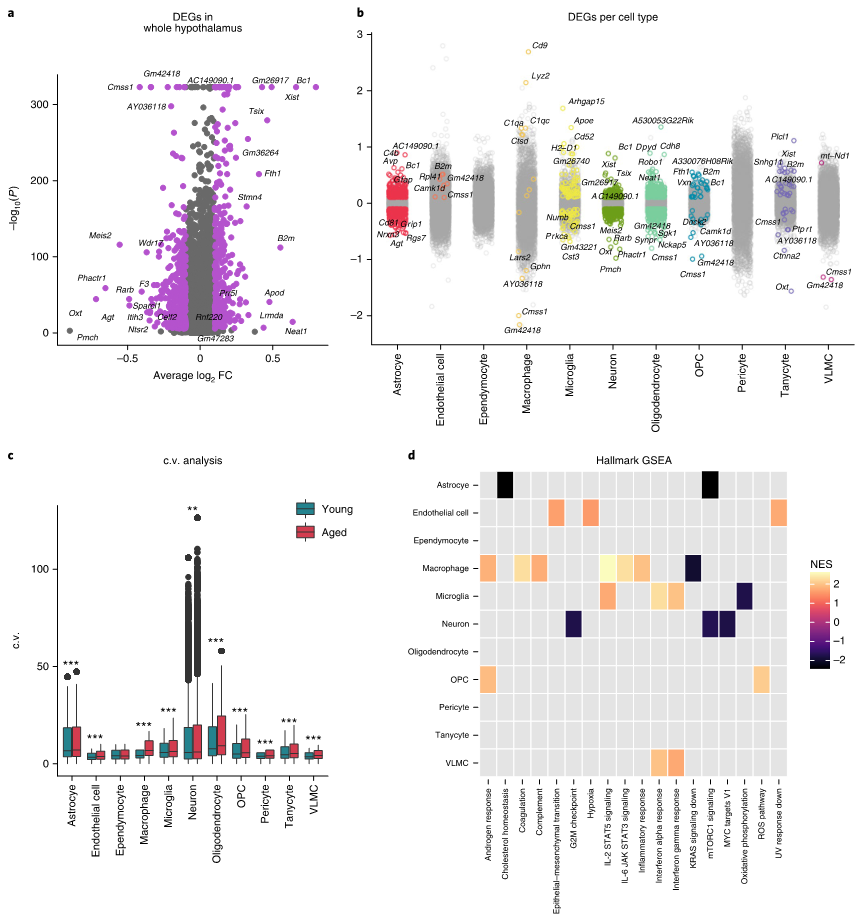
图2 衰老的下丘脑中细胞类型特异性的转录变化
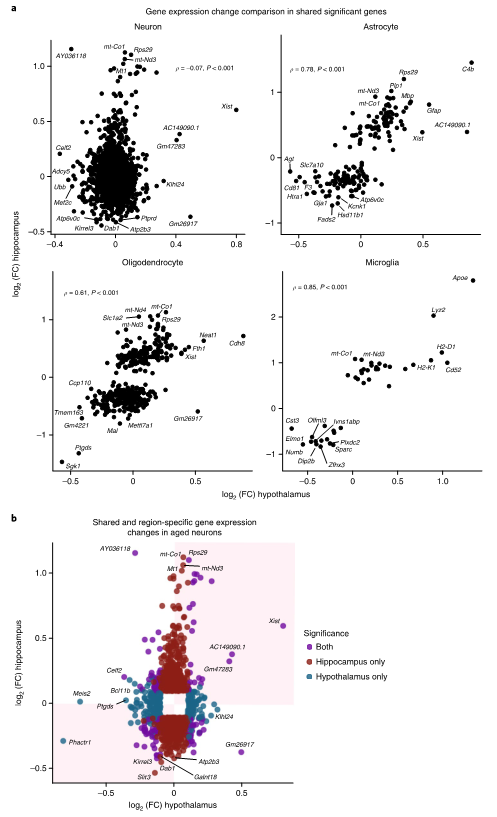
为了验证上述差异表达基因并确定其变化在多大程度上是下丘脑特异性的,作者将该数据集与一个公开的分析雌性小鼠海马的snRNA-seq数据集进行了比较。星形胶质细胞、少突胶质细胞和小胶质细胞在下丘脑和海马数据集之间显示高度一致性,而下丘脑神经元与海马神经元的基因表达变化相关性不大(图3a)。虽然一些基因,如Xist,在两个神经元数据中都随着年龄的增长而上调,但其他基因要么保持不变,要么向相反的方向调控(图3b)。
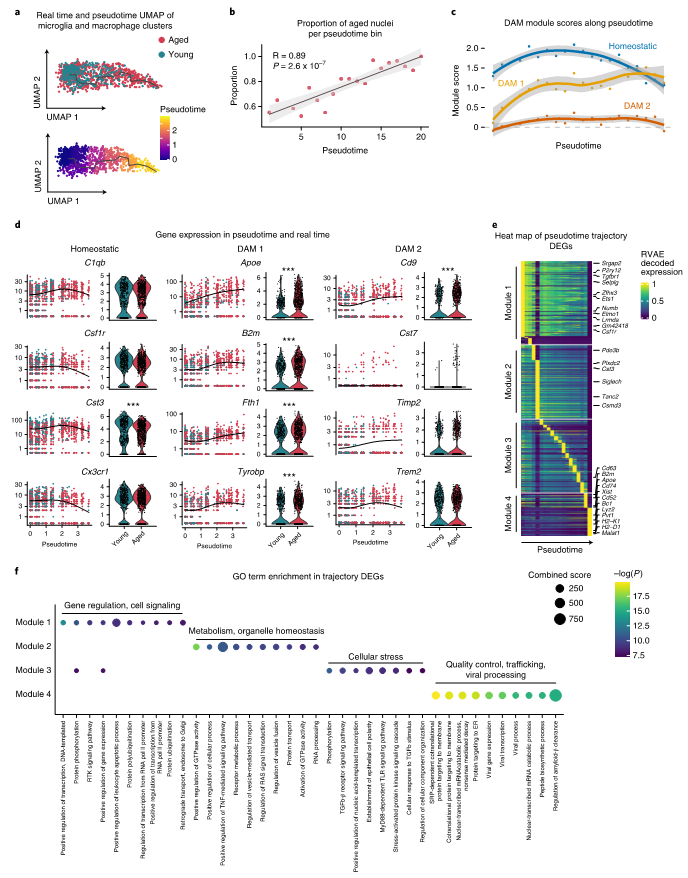
利用Monocle3对小胶质细胞和巨噬细胞进行拟时轨迹分析,该轨迹准确地捕获了从年轻细胞核到老化细胞核的转变,表明这些细胞类型的细胞逐渐老化及老化细胞核的比例随拟时显著增加(图4a,b)。参考先前研究结果分析拟时进程中疾病相关小胶质细胞(DAM)基因变化,沿拟时轨迹对3种小胶质细胞基因集(稳态、DAM1和DAM2)的模块分数绘图发现DAM1分数显著增加(图4c)。对这些模块中的基因在拟时和真实时间中进行表达分析,很多老化的小胶质细胞高表达疾病相关基因(图4d)。然后,作者利用RVAgene分析了拟时进程中表达动态变化,这些基因可以分成4个模块,并对4个模块的基因分别做了GO富集分析(图4e,f)。
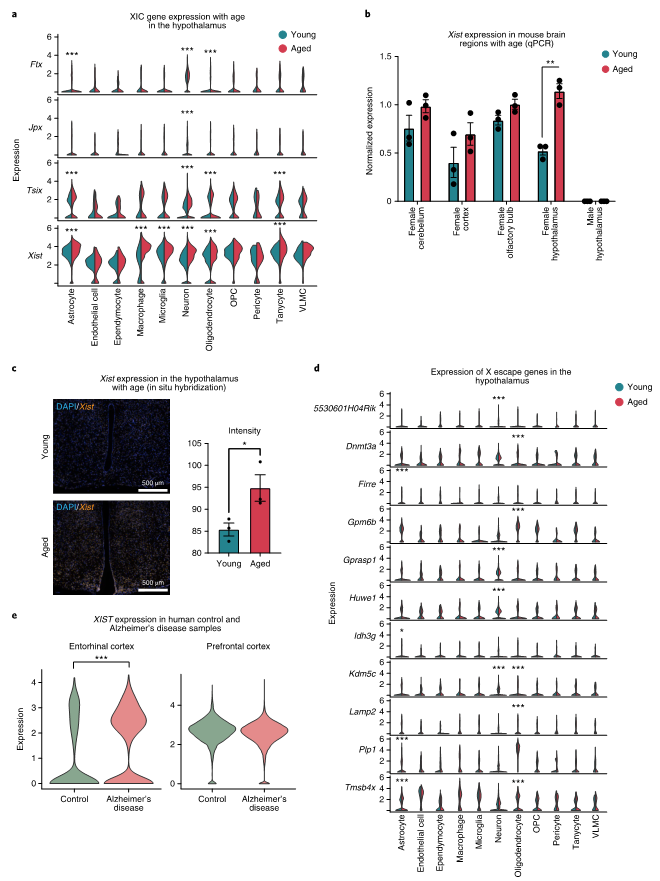
各主要细胞类型的差异表达分析表明,Xist在星形胶质细胞、巨噬细胞、小胶质细胞、神经元、少突胶质细胞和伸长细胞中随年龄的增长而上调,一些其它RNA也呈现出年龄相关的上调,包括Ftx、Jpx和Tsix(图5a)。不同脑区组织样本qPCR也证实了Xist表达上调(图5b),RNAScope实验也证实了Xist在衰老的雌性下丘脑中表达更高(图5c)。虽然在当前数据中,X染色体失活中心(XIC)基因的变化似乎在不同的细胞类型中是一致的,但X逃逸基因与年龄相关的表达的变化是细胞类型特异性的(图5d)。作者也对阿尔茨海默症的脑组织单细胞数据分析了XIST的表达,发现女性阿尔茨海默病患者的内嗅皮层中XIST上调,该区域是发病最早和最严重的区域之一(图5e)。
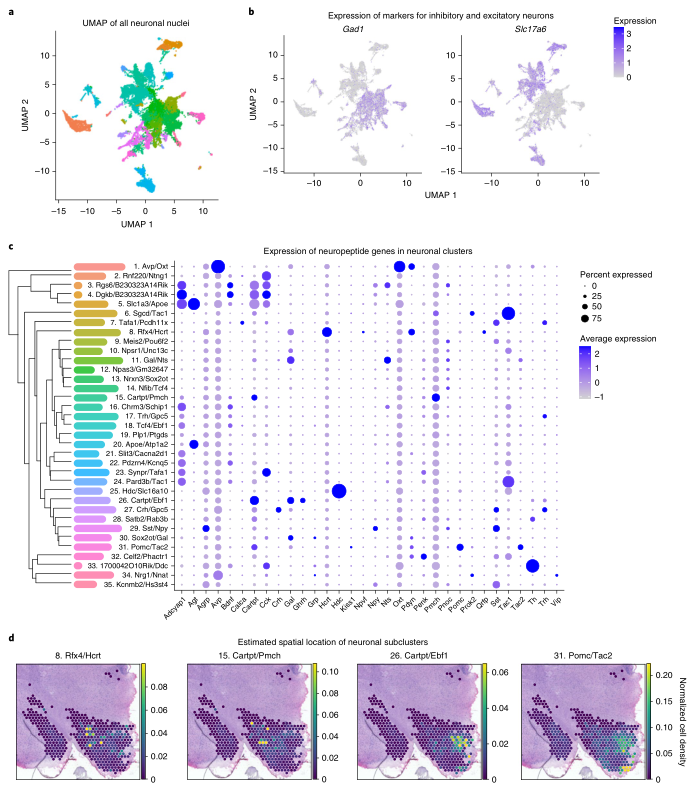
对下丘脑神经元进行亚群分析共识别35个cluster(图6a),整体上可以区分为抑制性或兴奋性神经元(图6b)。利用集群树(cluster tree)分析根据转录相似性区分这些cluster的关系,并研究了这些cluster的特定神经肽基因的表达,以从功能上定义不同的神经元亚群(图6c)。为了进一步确认神经元亚型的身份,作者将该数据集与Cell2Location公开的空间转录组数据进行了比较,结果显示特定神经元亚簇的mRNA特征位于离散的位置(图6d)。
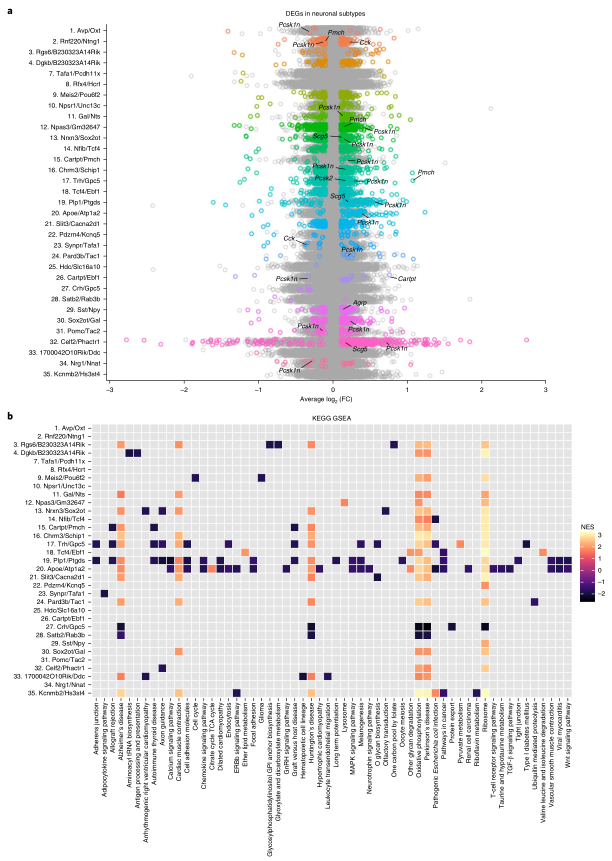
接下来,作者对每个条件下至少有20个细胞核的簇进行了差异表达分析(图7)和GSEA分析(图7)。多数cluster显示出与年龄相关的转录变化(图7a),而且在多个下丘脑神经元亚群中出现一些共同的衰老特征,包括富集在与阿尔茨海默症、亨廷顿病、氧化磷酸化、帕金森病和核糖体相关的通路上(图7b)。
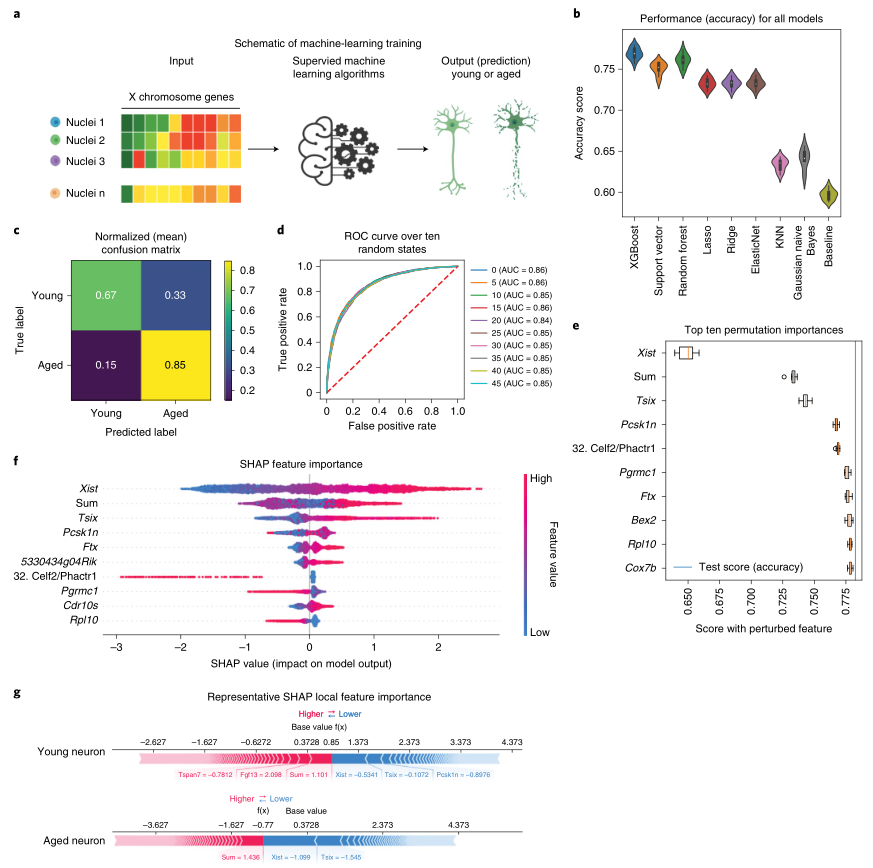
最后,作者试图理解Xist在定义老化神经元状态中的作用。为此,在数据集中测试X染色体基因的表达是否足以预测神经元年龄(图8a)。训练了8个不同的监督机器学习模型来将神经元分为年轻和年老两类。从准确率评分来看(图8b),XGBoost分类器的准确率优于其他分类器。然后,对模型进行微调以优化超参数,混淆矩阵(图8c)和ROC曲线下的面积(图8d)证实了模型的性能。值得注意的是,当随机打乱特征“Xist表达”时,模型性能急剧下降到接近基线水平(图8e)。然后,应用Shapley加性解释(SHAP)进一步解释预测,并按重要性对特征进行排序。与当前发现一致,Xist是预测中最重要的特征,其次是数据集中检测到的所有基因的总和(图8f)。两个随机选择的个体神经元(年轻和年老)的局部特征重要性也表明,Xist对驱动模型预测具有最显著的影响(图8g)。这些数据表明,Xist上调是下丘脑神经元衰老的一个关键特征,并可能预测雌性下丘脑神经元的衰老。
相关文章链接:
人类基底细胞癌的单细胞分析揭示了肿瘤生长和肿瘤微环境的新调控因子;

创新基因科技,成就科学梦想