
 咨询热线:400-065-6886
咨询热线:400-065-6886

 咨询热线:400-065-6886
咨询热线:400-065-6886


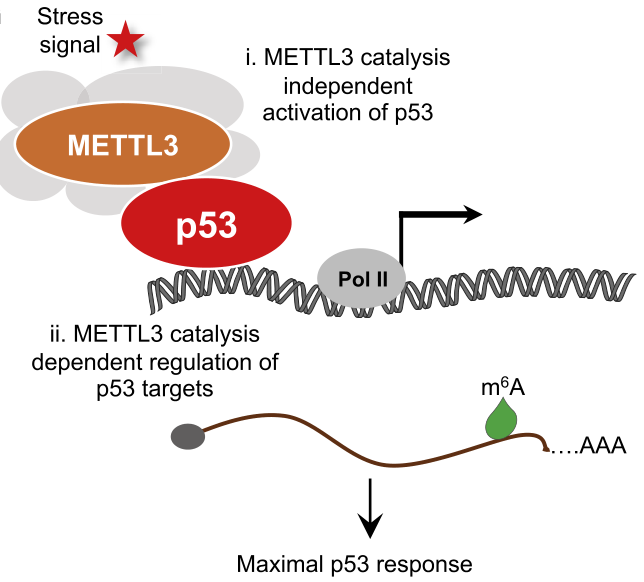
首先利用串联亲和纯化/质谱发现了与p53相互作用的多个蛋白,包括METTL3。继而利用免疫共沉淀和免疫印迹实验证实了p53和METTL3的相互作用(图1A-C)。在p53缺失的人或小鼠细胞中共同表达p53和METTL3后,注意到METTL3可以提高p53蛋白水平,提示METTL3可能会影响p53功能。而Mettl3缺失导致p53在应对DNA损伤(阿霉素,dox)时积累减少,伴随着各种p53靶基因的诱导减少,表明METTL3增强了p53蛋白的积累和转录活性。
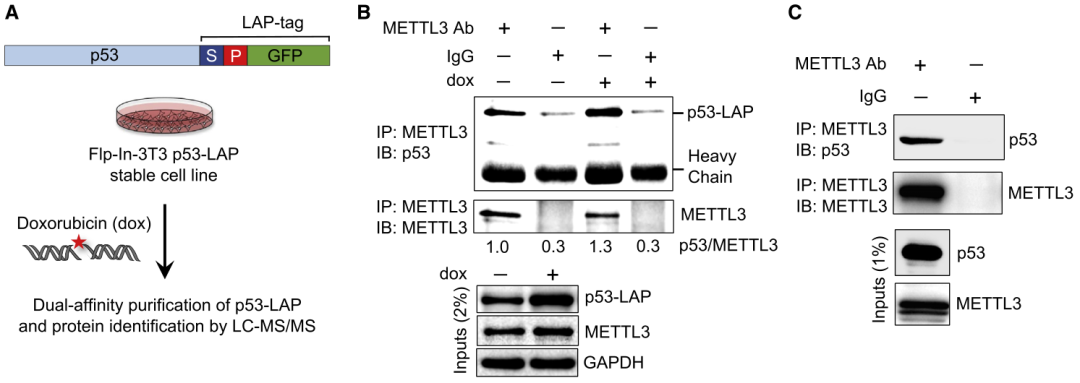
图1 METTL3与p53相互作用并增强了p53蛋白积累
在小鼠胚胎成纤维细胞(MEFs)模型中Mettl3敲低导致DNA损伤处理后(dox)p53积累减少。通过RNA-seq发现很多非经典的p53靶基因在Mettl3敲低后显著下调(图2D),对这些基因进行功能注释能够富集到p53通路(图2E,F)。事实上,对已知与p53结合并在MEFs特异调控的基因表达的分析证实了Mettl3敲低折中了DNA损伤诱导的表达,而不是这些基因的基础表达(图2G)。
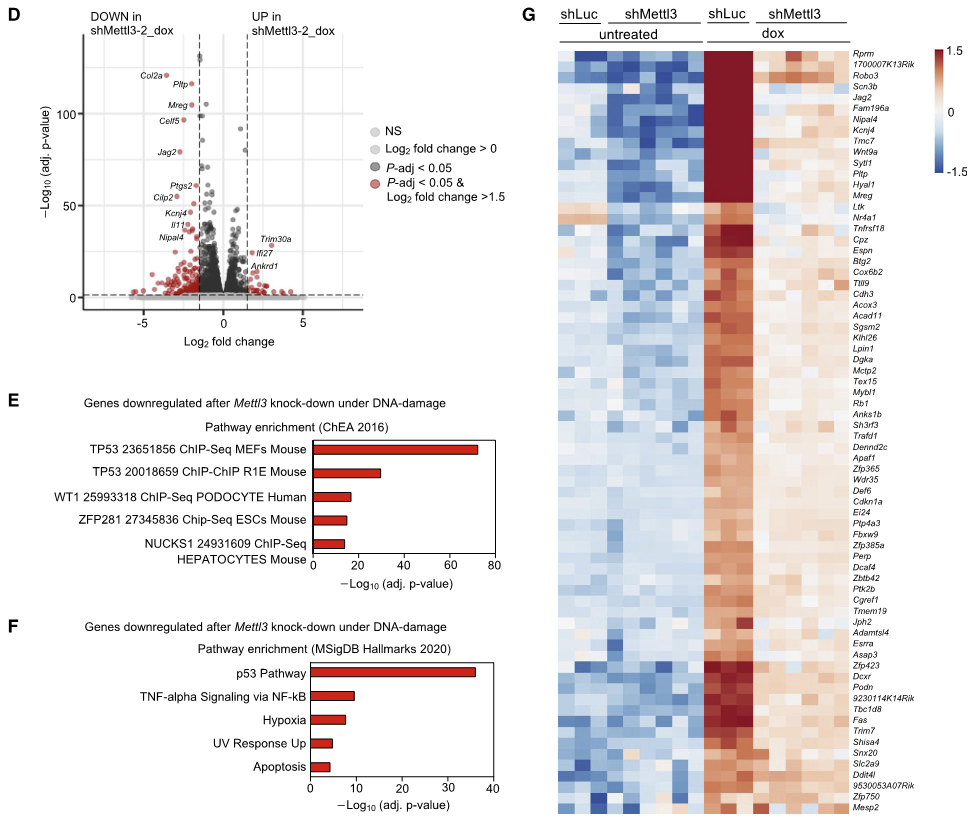
图2 METTL3促进p53转录程序响应DNA损伤
为了探究METTL3在p53通路上依赖催化活性的作用,通过m6A-eCLIP-seq实验确定了p53靶基因转录本在DNA损伤处理后显示出METTL3依赖的m6A修饰(图3),包括已知的p53靶基因(Neat1,Ptp4a3,Killer,Mdm2)和肿瘤抑制相关靶基因(Tex15,Sulf2,Polk,Slc19a2)。利用ChIP实验证实了METTL3可与p53靶基因染色质结合,直接进行m6A修饰,而这一作用在p53缺失时减弱,表明p53对于METTL3招募这些位点的重要性。这些研究结果表明METTL3对p53具有双重作用,主要是通过稳定p53,其次是通过p53通路中选定的转录本m6A修饰来增强它们的表达。
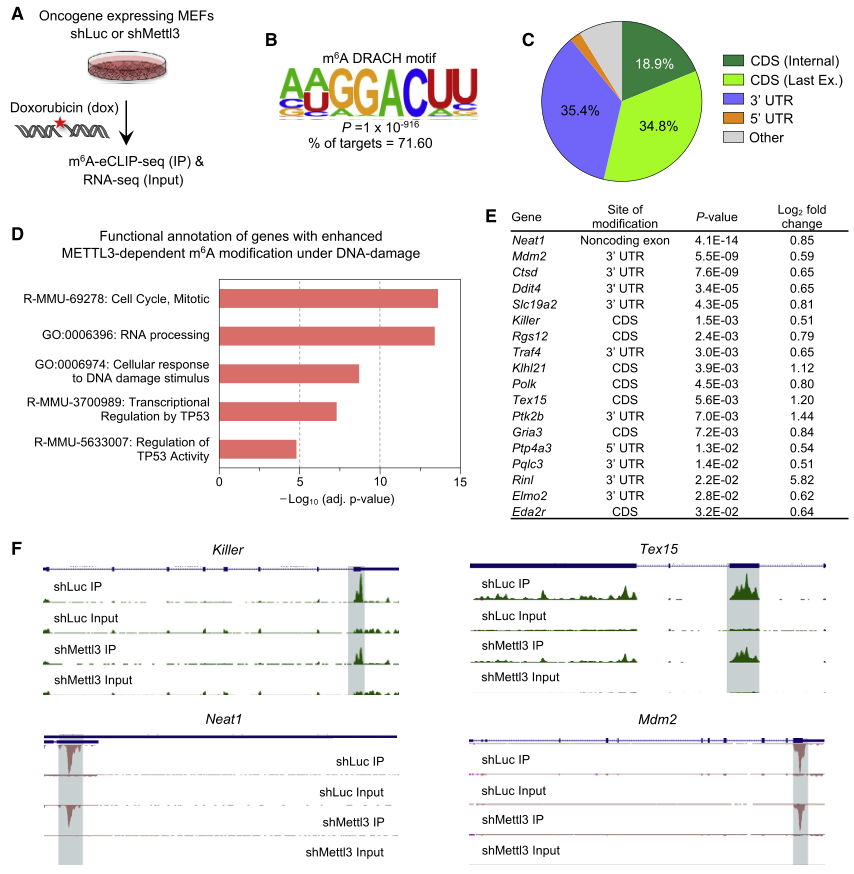
图3 DNA损伤下METTL3介导的p53靶基因转录本m6A修饰
为了确定METTL3是否也参与p53的抑癌功能,在小鼠MEFs模型中减弱METTL3蛋白表达增强细胞克隆潜能,敲低Mettl3都能显著增强p53野生型MEFs的体内肿瘤生长。另外,利用原发的小鼠肺腺癌模型结合CRISPR-Cas9基因编辑技术证实了Mettl3和Mettl14在体内肺腺癌中均有抑癌活性,其中p53在抑癌中有已经确定的作用(图4)。
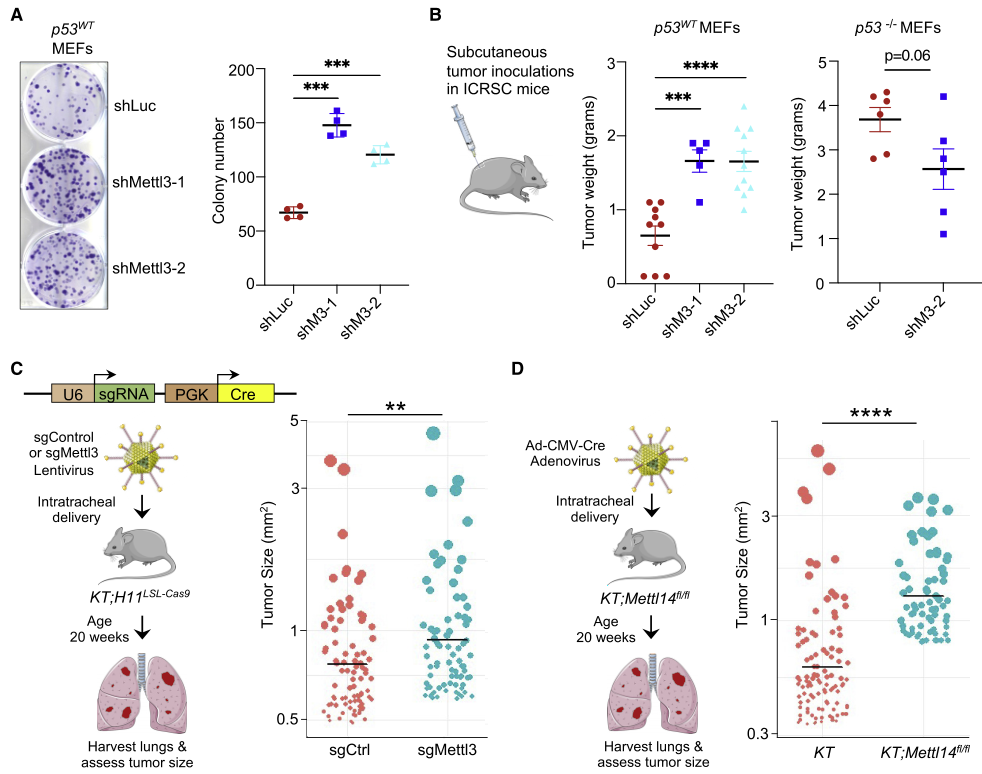
图4 在小鼠模型中,METTL3支持p53介导的肿瘤抑制
最后,研究人员利用TCGA数据探讨了p53-METTL3相互作用在人类癌症发展中的作用。在多个癌种中发现甲基转移酶复合物(MTC)与TP53呈现一种相互排斥的突变模式,这表明当MTC的成分发生突变时,突变TP53的选择压力较小。进一步分析也证实MTC是p53通路中的一种成分。

这项研究发现METTL3是一种新型的p53相互作用分子,在两个水平上增强p53活性中起着基础性作用。METTL3的主要作用是通过与p53的氨基末端结合,通过催化活性无关的机制来延长其半衰期。METTL3还可以通过在急性DNA损伤反应和肿瘤抑制中,在选定p53靶基因转录本上安装m6A修饰来促进p53活性,以确保它们的有效表达。

创新基因科技,成就科学梦想