
 咨询热线:400-065-6886
咨询热线:400-065-6886

 咨询热线:400-065-6886
咨询热线:400-065-6886
运动对健康的生理机能有益。然而,调控个人从事体育活动动机的机制仍然不完全清楚。在这里,研究者报道了在小鼠中发现的肠脑连接,该连接通过在体育活动中增强多巴胺信号来提高运动表现。研究者发现,肠道中产生了依赖微生物组的内源性大麻素代谢物,刺激TRPV1感觉神经元的活动,从而在运动过程中提高腹侧纹状体中的多巴胺水平。刺激该途径可改善跑步表现,而微生物组消耗、外周内源性大麻素受体抑制、脊髓传入神经元消融或多巴胺阻断会降低运动能力。这些发现表明,运动的奖励特性受到肠道衍生的内感受回路影响,并为运动表现个体间差异提供了微生物组依赖性的解释。本研究还表明,刺激肠道衍生信号传递到大脑的内感受模拟分子可能会增强运动的动力。

运动可能是最重要的生活方式组成部分,可以预防多种疾病。现代社会人类久坐不动的生活方式增加了代谢、神经和肿瘤疾病的风险,迫切需要有针对性的努力来扭转这一趋势。运动能力是肌肉骨骼系统、心血管和呼吸因素以及思想动机状态之间复杂相互作用的结果。在这项研究中,研究者测试了不同遗传背景和微生物组多样性远交小鼠的运动表现,并在认知生物学和神经生物学干预下进行了运动研究。研究者发现了一种代谢物触发的肠脑连接,它调控了运动的动机,通过传入神经元将肠道微生物组与中脑多巴胺信号联系起来。
为了确定影响运动表现的新调控因子,研究者使用了199只多样性远交(DO)小鼠的队列,其基因组来自八个确定的杂交遗传背景。研究者通过SNP基因分型、血清代谢组学、粪便样本的16S rDNA扩增子测序和多参数代谢分析对这一队列进行了深入分析(图1)。随后,通过小鼠自愿在轮子上跑步或在跑步机上耐力跑步进行运动分析。所有小鼠在运动前均未经训练。结果显示,动物在跑步机和轮子跑步方面存在明显差异。
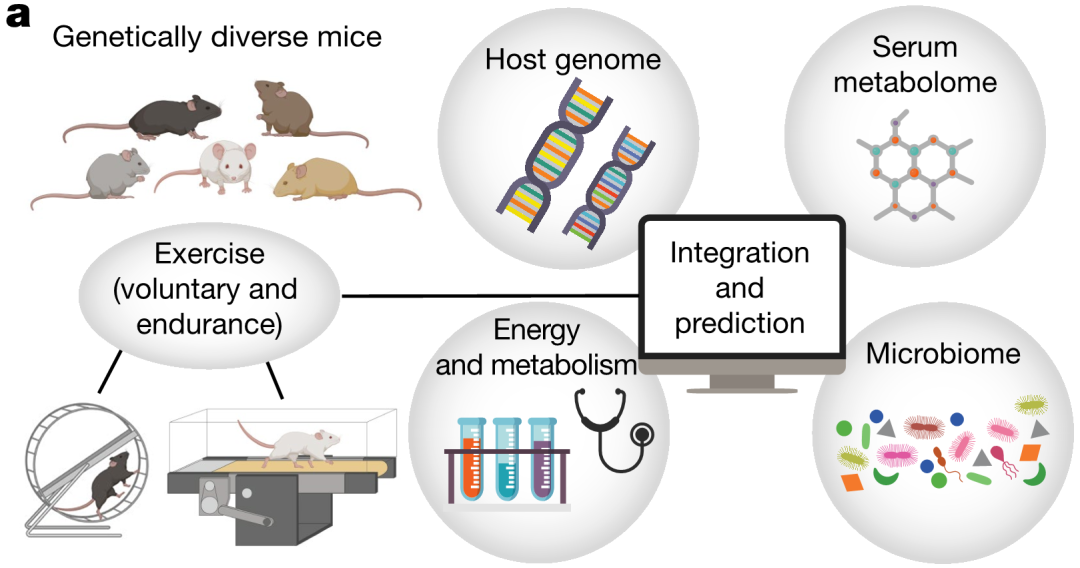
图1、对DO小鼠的基因组、微生物组、代谢组和能量代谢进行分析,并对运动表现进行评估。
为了探索这种差异性背后的因素,研究者首先关注宿主基因组。为此,研究者对小鼠进行了基因分型,构建了遗传亲缘矩阵,对每个跑步机参数进行了全基因组关联研究并计算了狭义遗传力,结果发现遗传力相当低(低于0.2),表明遗传对运动能力个体间差异的贡献很小。
因此,研究者对非遗传性参数进行评估,分析它们对运动表现的相对贡献。结果发现,血清代谢组、肠道微生物组组成和代谢参数在动物队列中差异很大。研究者使用机器学习方法来识别对运动表现有强烈预测贡献的变量。研究者训练了一种梯度提升决策树算法,该算法具有所有可用特征来预测跑步机的性能。为了识别驱动这些预测的特征,研究者将所有变量分类为“元组”并确定它们的相对贡献。值得注意的是,仅基于16S rDNA测序结果的预测所获得的准确度几乎与血清代谢组或所有测量参数组合所达到的准确性一样高。相比之下,主要的代谢和行为特征与运动耐力无关。
为了确定DO小鼠运动表现的个体间差异性在多大程度上是由微生物组驱动的,本研究进行了功能丧失(微生物组耗竭)和功能获得(微生物组移植)实验。使用广谱抗生素(Abx)消除微生物群会降低跑轮和跑步机的运动表现。微生物组样本从DO小鼠转移到无菌小鼠导致供体和受体的跑轮性能之间存在很强的相关性。这些结果表明微生物组对DO小鼠的运动能力有很强的功能贡献(图2)。
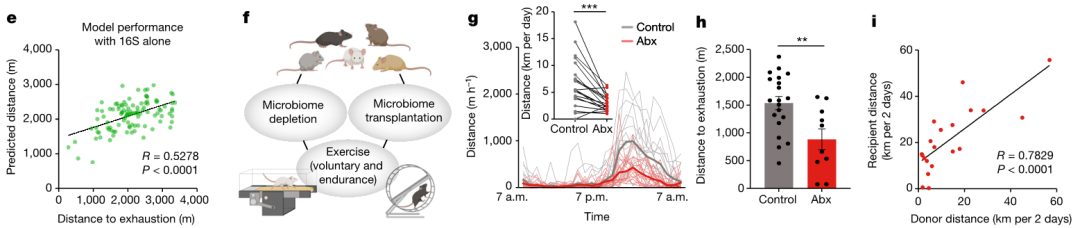
图2、基于仅来自16S rDNA测序的模型特征算法预测与测量的跑步机距离相关性分析,以及DO小鼠微生物组因果关系干预试验。
为了进一步确定微生物的影响,研究者使用C57BL/6J小鼠来人为改变肠道微生物,同时保持所有其他因素不变。研究者首先在多种正交方法中检测了微生物组的因果关系。广谱抗生素的微生物消除使跑步机和跑轮表现降低了约50%。为了确定这些观察结果不是由于口服抗生素的潜在副作用,研究者在无菌条件下对无菌小鼠进行了运动测试,结果显示出类似的性能降低。在雄性和雌性小鼠中都观察到最佳运动表现的微生物组依赖性。重要的是,停止抗生素处理以及无菌小鼠的常规化完全恢复了性能,表明微生物组消除对运动的影响是急性和可逆的。
之后研究者对用新霉素和氨苄青霉素处理的小鼠进行了16S rDNA扩增子测序,并对结果与从DO队列中获得的结果进行了比较分析。研究者使用SHapley加性解释(SHAP)评估了预测模型中单个微生物组特征的贡献。研究者首先根据平均绝对SHAP值对微生物组元组的所有变量进行排名,发现Erysipelotrichaceae和Lachnospiraceae科的几个成员可能是运动表现的驱动因素。然后,研究者通过在小鼠中进行单定植实验来测定单个微生物物种的贡献。研究者用有助于预测运动表现的Erysipelotrichaceae科成员(直肠真杆菌Eubacterium rectale)接种无菌小鼠,同样参与运动预测的Lachnospiraceae科成员(规则粪球菌Coprococcus eutactus),以及预测对运动没有作用的(布劳特氏菌Blautia producta)和(活泼瘤胃球菌Ruminococcus gnavus)。研究者通过16S定量PCR和测序确定了定植成功。与无菌小鼠相比,Eubacterium和Coprococcus增强了运动表现,达到了与传统定植小鼠相当的水平,而Blautia和Ruminococcus则没有。这些数据共同证明了微生物组在调控运动表现方面的因果作用,并突出了Erysipelotrichaceae科和Lachnospiraceae科的某些成员作为可能的贡献者。
接下来,研究者试图确定微生物组影响运动表现的机制。根据之前的报道,研究者假设最佳肌肉功能需要完整的微生物组。肌肉功能、氧气消耗或转录组学的离体测试并未显示抗生素处理的主要效果,这表明肠道微生物组对自愿和耐力运动的显著影响可能不是由肌肉生理学的变化介导的。
除了肌肉骨骼功能之外,运动表现的主要贡献者是动机状态。参与动机行为和身体活动启动的大脑区域主要是纹状体。为了探索微生物组对运动纹状体反应的影响,研究者在跑步机运动前后对抗生素处理小鼠的纹状体进行了单细胞核转录组测序。研究者总共对44,100个细胞进行了测序,并标记鉴定了细胞类型。然后,研究者将重点放在神经元群体上,并确定了表达多巴胺受体D1和D2中棘神经元的主要群体。研究者注意到,Arc和Fos等早期基因的表达因运动而强烈升高;然而,在没有微生物组的情况下,这种升高受到抑制。这些数据表明,肠道微生物定植对于运动触发的纹状体激活很重要(图3)。
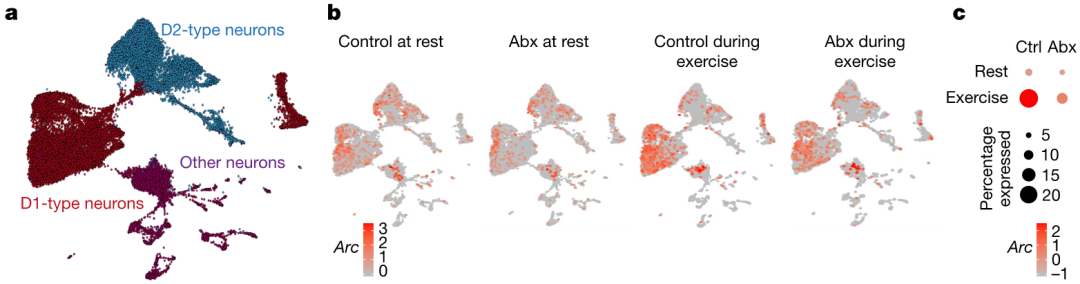
图3、微生物组影响纹状体中运动诱导的多巴胺反应。a,运动前和运动期间来自对照和Abx处理小鼠纹状体单细胞核转录组神经元的UMAP图。(b, c)运动期间对照和Abx处理小鼠纹状体神经元中Arc表达的UMAP图和定量结果。
纹状体介质多刺神经元由多巴胺控制,多巴胺是身体活动驱动的关键调控因子,研究者接下来测量了微生物组耗尽小鼠的纹状体多巴胺水平。正如预期的那样,运动后纹状体多巴胺水平升高。值得注意的是,这种升高在微生物组耗尽的小鼠中被钝化,表明肠道微生物定植是运动后多巴胺有效释放所必需的。通过使用荧光多巴胺传感器实时测量多巴胺水平,表明在不同的运动时间后,腹侧和背侧纹状体中的多巴胺快速和持续上调。引人注目的是,这种多巴胺反应在抗生素处理的动物中几乎被消除,进一步强调了微生物组对纹状体多巴胺对身体活动反应的重要性。
接下来,研究者评估了来自运动后纹状体多巴胺水平与DO小鼠车轮运行相关的发现。其次,接受运动增强微生物组移植的无菌小鼠,无论是来自表现最佳的DO小鼠还是来自常规定植的C57BL/6小鼠,也表现出多巴胺水平的升高。第三,通过药理学多巴胺受体拮抗剂舒必利或通过对腹侧被盖区多巴胺能神经元的化学遗传学抑制(VTA)抑制多巴胺信号传导,表型复制了微生物组耗竭的作用。此外,药理学多巴胺受体激动剂溴隐亭激活多巴胺信号恢复了抗生素处理小鼠的运动表现。这些实验表明,纹状体多巴胺信号传导是微生物组对运动活动影响的重要介质。
研究者考虑多巴胺水平可能受到纹状体差异周转的突触后影响的可能性。多巴胺降解由单胺氧化酶(MAO)调控。值得注意的是,Maoa的纹状体表达在运动小鼠中受到抑制,这在没有肠道微生物组的情况下不会发生。因此,研究者假设持续的MAO水平是微生物组消耗小鼠运动多巴胺反应迟钝的原因,并且MAO的阻断将使多巴胺信号正常化。事实上,药理学MAO抑制增强了运动诱导的多巴胺水平并恢复了抗生素处理小鼠的跑步性能。这些结果表明,肠道微生物定植通过限制MAO驱动的多巴胺周转来增强纹状体中运动诱导的多巴胺信号传导。
本研究整合了遗传和微生物组学多样化的小鼠、在单菌定植条件下进行了运动试验、神经生物学干预和代谢组学,以揭示肠道微生物组对参与运动表现的大脑回路的影响。本文结果表明,肠道微生物组有助于肠道FAA代谢物的产生,这些代谢物触发表达CB1的TRPV1感觉神经元,进而向大脑发送运动诱导的传入信号,并促进纹状体中MAO表达的下调。MAO的这种下调有助于提高多巴胺水平和增强运动能力。在没有微生物组的情况下,传入信号受到抑制,MAO水平持续存在,因此运动引起的多巴胺激增被削弱,对身体运动表现产生重要影响(图4)。
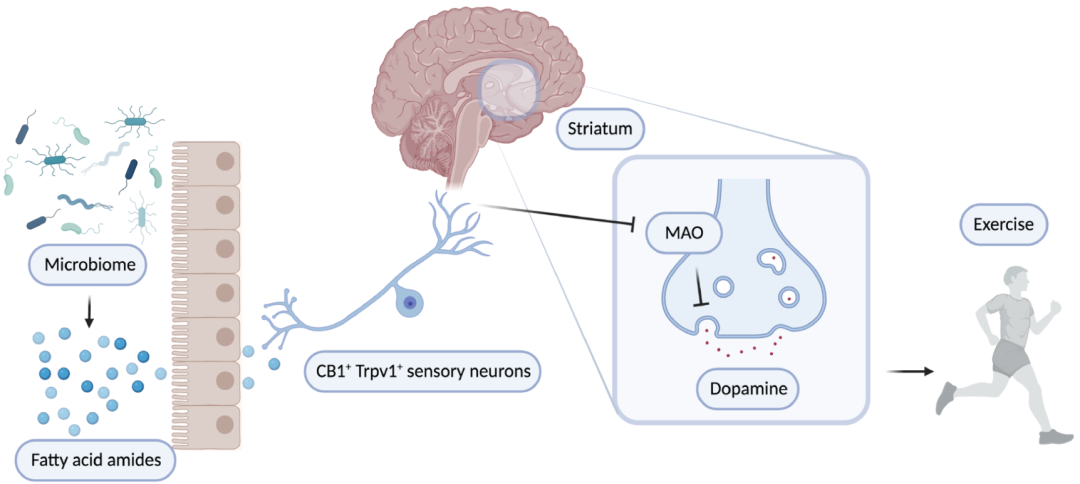
图4、肠道微生物群与运动关联的途径模型示意图
盘点 | 天昊生物专利技术--Accu16S细菌与AccuITS真菌绝对定量测序客户文章汇总(医学篇);
盘点 | 天昊微生物组(扩增子/宏基因组)+代谢组客户高分文章(医学/食品/农学);
恭喜!天昊16S扩增子助力益生菌肾病治疗研究登陆一区Top杂志《Circulation Research》(IF 23.213);
喜讯!天昊微生物项目文章登陆国际顶尖期刊《Advanced Science》;
喜讯!天昊Accu16S细菌绝对定量技术助力客户股骨头坏死研究登陆Science子刊《Science Advances》;
喜讯!天昊微生物项目文章登陆国际精神疾病领域顶级期刊《Molecular Psychiatry》;
再发“昊”文!天昊微生物项目文章登陆肠道微生物领域顶尖期刊《Gut Microbes》;
祝贺!天昊16S扩增子+宏基因组+代谢组助力浆水酸奶研究登陆一区杂志《npj Biofilms and Microbiomes》;
祝贺!天昊微生物扩增子测序及代谢组学联合分析助力客户泼尼松药物研究见刊《Microbiology Spectrum》;
项目文章 | 微生物扩增子测序及代谢组学联合分析揭示香烟烟雾混合致癌物对小鼠肠道微生物群和代谢稳态的影响;
【Nature Reviews】:肠道菌群中的碳水化合物活性酶(CAZymes);
【Nature Genetics】评述:宿主遗传对肠道微生物群影响的挑战和未来方向;
