肝内胆管癌(iCCA)是仅次于肝细胞癌的第二大原发性肝脏恶性肿瘤,其预后差,在全球范围内发病率上升。作为一种高度异质性疾病,iCCA可起源于位于二级胆管以上胆管树的任何点的胆管细胞。最近,世界卫生组织和欧洲胆管癌研究网络认识到iCCA可以分为两种主要组织学不同的亚型,包括门部大导管型(iCCAphl)和周边小导管型(iCCApps),根据受侵犯胆管的水平和大小。事实上,新出现的证据表明,iCCA的两种组织学亚型具有不同的细胞起源和发病机制。
iCCAphl通常被认为来源于肝内大胆管,主要由产生粘蛋白的胆管细胞组成。与iCCApps相比,这种亚型的iCCA以粘液高分泌为特征,有较高的淋巴结转移率和较差的生存期。研究报道 MUC5AC和S100P作为重要的标志物常在iCCAphl中过表达。相反,iCCApps通常被认为起源于肝内小胆管,没有或很少产生粘蛋白。已经发现iCCApps更频繁地表达CDH2和NCAM。
尽管这两种iCCA亚型在粘蛋白产生、肿瘤细胞形状和患者预后方面表现出显著差异,但目前还没有共识和明确的标记物来区分它们,我们对它们的生物学、分子和治疗差异的认识仍然有限。单细胞RNA测序(scRNA-seq)是一项强有力的癌症研究技术,先前的scRNA-seq研究报道了iCCAs中肿瘤微环境的复杂性,但没有考虑到其组织学分类,这可能不能准确地反映该肿瘤的多样性。
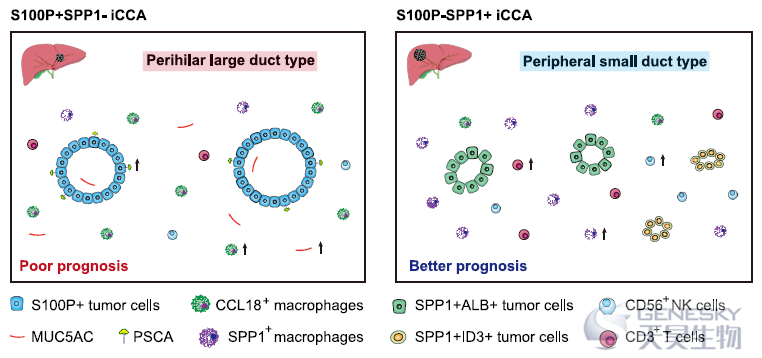
2022年3月28日,复旦大学附属中山医院肝肿瘤外科樊嘉、高强课题组联合北京大学数学科学学院席瑞斌课题组和中科院上海巴斯德研究所张晓明课题组在Nature Communications杂志发表了最新研究成果“Single-cell transcriptomic analysis suggests two molecularly subtypes of intrahepatic cholangiocarcinoma”,利用单细胞RNA测序发现了上述iCCA两种组织学亚型的标记物S100P和SPP1。与S100P-SPP1+ iCCApps相比,S100P+SPP1-iCCAphl增加了CCL18+巨噬细胞浸润,降低了SPP1+巨噬细胞浸润,具有侵袭性表型,而且预后较差。

该研究将scRNA-seq和全外显子组测序(WES)应用于14例未经治疗的iCCA患者的肿瘤和配对的邻近非肿瘤肝组织(如下图a)。单细胞数据质控后共获得144,878个细胞数据,包括13种主要细胞类型(图b)。推断拷贝数(inferCNV)分析发现了23,667个恶性上皮细胞(图c),与其它癌种类似,恶性细胞表现出较强的瘤间异质性,形成了患者特异性的簇(图d)。
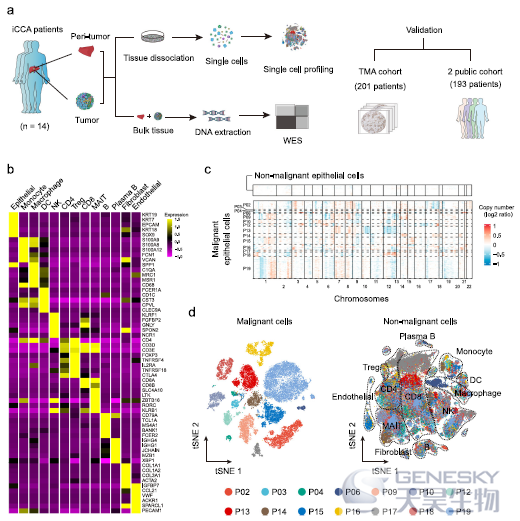
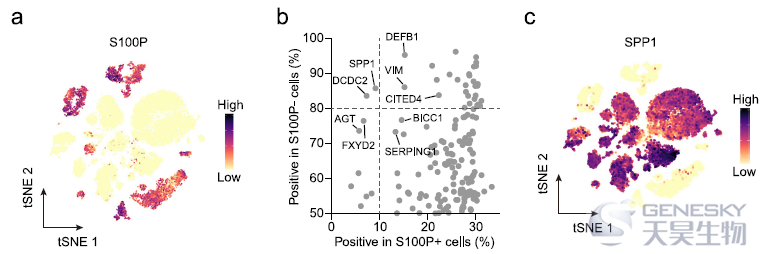
为了在单细胞水平上探索不同细胞来源的iCCA亚型,作者检测了先前提出的iCCAphl标记物和iCCApps标记物在恶性细胞中的表达(如下图a)。发现14个iCCAs样本中有7个表现出iCCAphl标记物如S100P和MUC5AC的高表达,表明它们来自肝内大胆管。S100P+细胞占这7个iCCAs肿瘤细胞总数的91.14%,因此,S100P作为iCCAphl标记物更具有代表性。剩下的7个S100P- iCCAs样本中,发现SPP1与S100P的表达相互排斥,但在iCCApps中广泛表达。因此,S100P可以作为iCCApps潜在的生物标记物(图b)。7个S100P- iCCAs样本在细胞和组织水平均表现出SPP1的高表达(图c)。因此,根据S100P和SPP1的表达情况,将14个iCCAs分为S100P+SPP1- iCCAphl和S100P-SPP1+ iCCApps亚型。
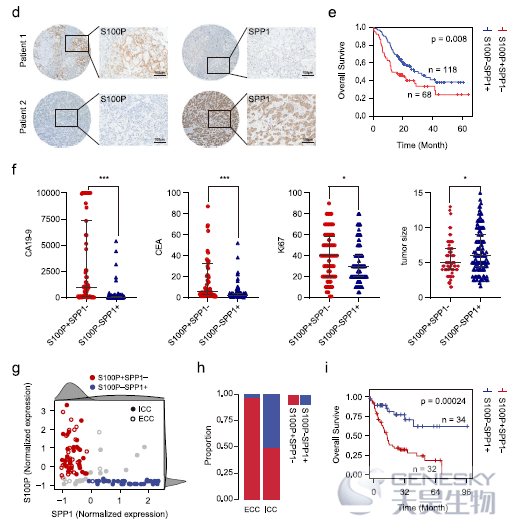
作者通过免疫组化验证了iCCA中S100P和SPP1的表达相互排斥(如下图d),生存分析显示S100P+SPP1-比S100P-SPP1+亚型iCCA具有更差的预后(图e)。进一步分析了不同亚型iCCA与临床数据的相关性(图f),并且在其它的胆管癌RNA测序数据中验证了S100P和SPP1在区分iCCAphl和iCCApps的作用(图g-i)。这些数据均表明S100P和SPP1是两个最佳的标志物,能够将iCCA患者区分成两种不同细胞起源和临床病理特征的亚型。
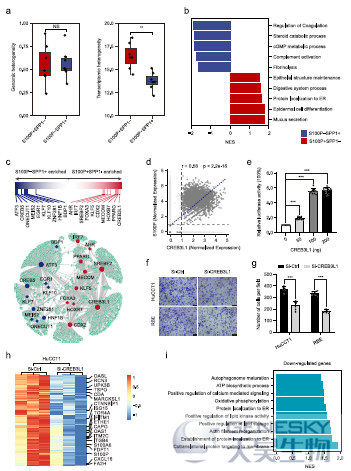
在iCCA中发现两种主要的恶性细胞亚群后,作者想研究其独特的分子特征。分析发现两种iCCAs基因组瘤内异质性(ITH)并无显著差异,而S100P+SPP1-亚型转录组ITH显著更高(如下图a)。S100P-SPP1+细胞中上调的基因主要富集在凝血和补体激活的调控中,这涉及到肝细胞的功能(图b)。应用SCENIC分析来表征两类细胞之间的转录网络(图c)。S100P+SPP1-细胞中上调的CREB3L1是一个潜在的调控S100P的转录因子,CREB3L1表达与S100P表达呈强正相关(图d)。作者还设计了双荧光素酶报告实验、Transwell实验和RNA seq确定了S100P作为CREB3L1的直接靶点(图e-i)。这些结果揭示了S100P+SPP1-和S100P-SPP1+细胞不同的转录特征,确定了CREB3L1作为S100P的潜在转录因子,促进iCCAphl的侵袭。
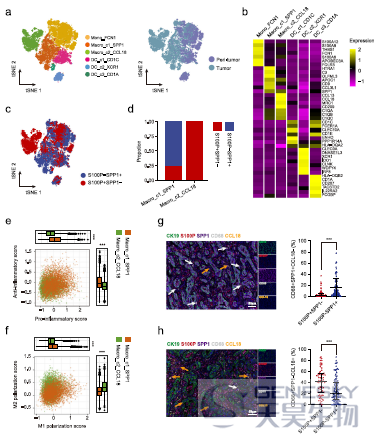
尽管有scRNA-seq研究iCCA的肿瘤免疫微环境,但是iCCAphl和iCCApps之间的免疫图谱差异仍然未知。作者将研究重点集中在巨噬细胞亚群的浸润中。在髓系谱系中,重聚类分析发现1个单核细胞、2个巨噬细胞和3个树突细胞群(如下图a, b)。SPP1+巨噬细胞在S100P-SPP1+ iCCApps中浸润更多,而CCL18+巨噬细胞,主要浸润在S100P+SPP1- iCCAphl中(图c, d)。通过计算促炎/抗炎和M1/M2极化分数,发现SPP1+巨噬细胞表现出促炎和抗炎反应,并倾向于M1极化(图e, f)。免疫染色也进一步证实了这两种巨噬细胞在iCCAphl和iCCApps中不同的富集(图g, h)。这些结果表明,iCCAphl具有独特的免疫生态系统,与iCCApps相比,CCL18+巨噬细胞增加,CD3+ T和CD56+ NK细胞减少。
作者在分析肝细胞marker ALB时发现大多数表达ALB的肿瘤细胞(79.4%)出现在S100P-SPP1+ iCCApps中。通过比较iCCApps中ALB+和ALB-细胞的基因表达谱,发现ALB-细胞高表达ID3(如下图a);而ALB+细胞高表达一些肝细胞特异性基因(图b)。进一步挑选P09和P10患者的肿瘤细胞进行轨迹分析发现ALB+细胞主要位于轨迹末端,参与凝血调控、ER腔和ER应激反应的基因沿着轨迹逐渐增加(图c, d)。同时,MKI67的表达与ALB的表达趋势一致,提示ALB+细胞的增殖能力增强(图e)。这些结果表明iCCApps是一种异质性肿瘤,其肿瘤细胞处于不同的分化状态。
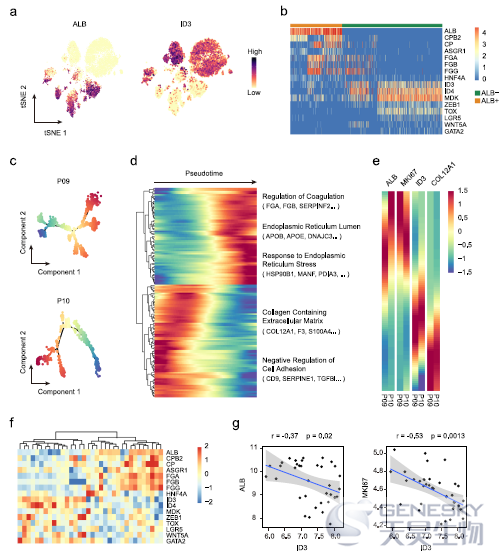
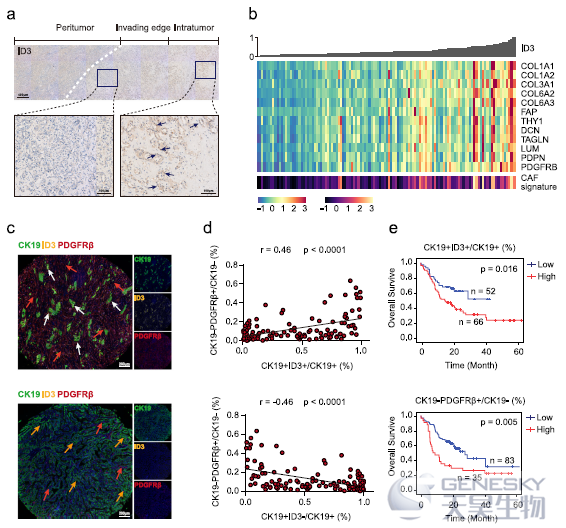
接下来作者探讨了ID3+ iCCApps的临床和组织学特征。免疫染色发现ID3主要表达于位于肿瘤中心的肿瘤细胞核中,并被丰富的基质成分包围(如下图a)。进一步探讨ID3表达与肿瘤基质的关系,在两个公共数据库中发现ID3的表达与肿瘤相关成纤维(CAFs)的基因特征呈正相关(图b)。
由于CAFs在肿瘤进展和化疗耐药中发挥重要作用,作者推测ID3的表达与iCCA的预后有关。选择了118个S100P-SPP1+ iCCApps来探讨ID3+肿瘤细胞和PDGFRβ+基质细胞的预后价值(图c)。如所料,CK19+ ID3+肿瘤细胞比例与CK19-PDGFRβ+细胞比例呈正相关(图d);生存曲线显示,在iCCApps中,CK19+ ID3+肿瘤细胞比例和CK19-PDGFRβ+细胞比例均与不良预后显著相关(图e)。因此,这些结果表明,ID3+细胞通常与iCCApps中CAFs的存在和患者生存相关。
总结来看,这项研究结果表明iCCAphl和iCCApps具有不同的细胞起源。然而,通常很难或不可能通过传统的方法来准确区分它们,比如评估它们的细胞形态、结构特征或粘蛋白产量,因为有一定比例的iCCAs含有大导管和小导管类型的混合物,并表现出不典型的组织学,联合检测多种组织标志物的表达有助于区分它们。本研究提出了两个标记物,S100P和SPP1区分iCCAphl和iCCApps,这可能为了解不同细胞起源的iCCAs提供了线索。
咨询沟通请联系
18964693703(微信同号)

创新基因科技,成就科学梦想

 咨询热线:400-065-6886
咨询热线:400-065-6886

 咨询热线:400-065-6886
咨询热线:400-065-6886









