
 咨询热线:400-065-6886
咨询热线:400-065-6886

 咨询热线:400-065-6886
咨询热线:400-065-6886
近期,在Gut杂志上刊登了一篇探讨肠道菌群与人类健康关系的综述论文。在这篇综述中,作者讨论了肠道菌群是如何与机体保护或发病之间可能存在的因果关系及其分子机制。分析了相关的代谢产物(即短链脂肪酸、胆汁酸、三甲胺N-氧化物),并将其扩展到最近鉴定的活性分子(即内源性大麻素、生物活性脂质、酚类衍生化合物、晚期糖基化终末产物和肠道生物活性分子enterosynes)及其特异性受体,如过氧化物酶体增殖物激活受体α(PPARα)和γ(PPARγ)、芳香烃受体(AhR)和G蛋白偶联受体(即GPR41、GPR43、GPR119、Takeda G蛋白偶联受体5)。正确理解肠道微生物与健康联系的复杂性和分子机制将有助于为正在开发的新疗法奠定基础。今天我们就来详细看下这篇文章。
英文题目:Gut microbiome and health: mechanistic insights
中文题目:肠道菌群与健康:机制见解
期刊名:Gut
影响因子:23.059
发表时间:2022年2月
人类肠道菌群
人类微生物组在这里指的是微生物及其基因和产物的集合,它们自出生起就定殖在我们的身体上,并可以垂直转移。虽然它们在所有身体部位都有定殖,但在肠道中发现的微生物数量最多(图1)。在这里,我们回顾了涉及肠道微生物的活动,以及分子介质对我们健康影响的主要的和最新发现。
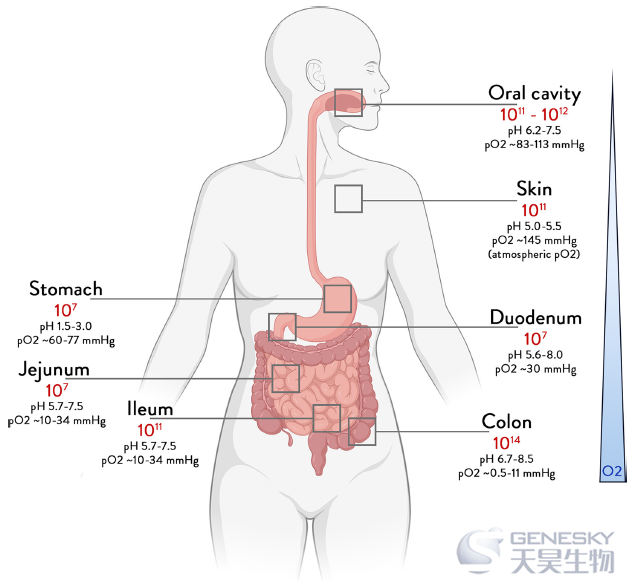
图1、不同身体部位的细菌总数。
在健康受试者中,口腔和唾液微生物群包含数百万级的微生物,这些微生物每天与我们的食物一起被吞咽,但它们在肠道中的持久性受到许多因素的阻碍,包括胃的酸度、胆汁酸(BAs)、消化酶和十二指肠及其他部位的抗菌蛋白的产生。大量其他主要变量会进一步影响下游微生物的定殖,如pH值、氧浓度和氧化还原电位等化学参数、粘液、胆汁和抗体的生物产量,以及物理方面,包括肠道结构、蠕动和转运时间(图1)。因此,沿着小肠发现了微生物的浓度梯度。研究发现十二指肠吸出物中的微生物丰度比口腔样本中的微生物丰度低1000倍,尽管包含的微生物类群有些相似。因此,小肠每克内容物中包含数千到数亿个细菌,其中部分耐氧的厚壁菌门和变形菌门是主要的门。每克高达1000亿个细菌的群落在此停留长达几天,因为在结肠中的运输时间比在小肠中长十几倍。因此,结肠微生物群主要由厌氧菌控制,包括数千个物种和数百万个基因,分布在厚壁菌门(主要是乳球菌科和乳酸杆菌科)、拟杆菌门、放线菌、变形菌和疣微菌(Akkermansia)的主要门中(图1)。作为粪便排出,正是这种生物量构成了通常所说的肠道菌群,该微生物群与多种疾病有关,并且可通过饮食和药物高度改变(表1)。它为粪便微生物群移植(FMT)提供了起始材料,该移植已被证明可治愈复发性艰难梭菌感染和其他疾病的患者。
表1、PubMed列出的关于“微生物组和疾病”主题的文章
肠道菌群与各种肠内外疾病
肠道菌群与多种肠内和肠外疾病有关。许多肠道菌群及其相关性的大型研究已在特定的胃肠(GI)疾病中进行,如肠道疾病(IBDs)、乳糜泻、肠易激综合征(IBS)、结肠直肠癌(CRC)、慢性肝病或胰腺疾病。肠道的原型炎症性疾病IBDs与肠道菌群组成失调有关,而且据报道,确实存在兼性厌氧菌生长。特别是在活动性炎症和代谢紊乱(包括BAs、短链脂肪酸(SCFAs)和酰基肉碱途径)的情况下。对乳糜泻(另一种常见的炎症性肠道疾病)风险分析表明,在疾病发作前,几种微生物物种(如隐形双歧杆菌、类杆菌或乳酸杆菌)和某些代谢物(如色氨酸代谢物)的存在增加,而各种抗炎菌株(如粪大肠杆菌或梭菌)的存在减少。IBS作为一种常见的胃肠道功能障碍,与肠道菌群和相关代谢物中的IBS亚型特异性变化有关,嘌呤代谢尤其受到影响。结直肠癌是下消化道中最常见的恶性肿瘤,已被证明与紊乱的肠道菌群有关,并涉及某些细菌,如具核梭杆菌、大肠杆菌或脆弱拟杆菌,其中一些细菌来自口腔微生物群。慢性肝病,尤其是晚期肝病,如肝硬化。以严重的微生物异常为特征,益生元、益生菌和抗生素的干预研究数据充分证明,肠道菌群在这些疾病中起着关键作用。胰腺癌是西方世界越来越公认的恶性肿瘤,也与肠道菌群受损有关,因为肿瘤内微生物群的组成会影响宿主的免疫反应和疾病的自然病程。
在过去的几年中,肠道微生物组在肥胖和肥胖相关疾病中得到了广泛的研究,例如二型糖尿病(T2D)和非酒精性脂肪性肝病(NAFLD)。许多研究试图将肠道菌群的改变与肥胖联系起来,事实上,对某些细菌菌株(如Akkermansia muciniphila)的干预研究显示了对肥胖相关参数的影响。亚洲和欧洲人群的肠道菌群受损也是T2D的特征。在T2D中,微生物变化与胰岛素抵抗的存在密切相关,一些研究表明肠道菌群影响葡萄糖调节。NAFLD是目前西方世界最常见的慢性肝病,被认为是肥胖、代谢综合征和T2D之间的典型代谢紊乱。越来越多的证据表明,肠道菌群-肝脏轴在NAFLD中发挥了作用,尤其是在纤维化和向更晚期疾病发展的情况下,如非酒精性肝脂肪变性。几项研究现已证明,NAFLD的特征是某些肠杆菌科细菌、大肠杆菌大量繁殖,以及镰孢菌减少。最近的数据还表明,NAFLD微生物组的失调和不稳定性可能存在多年,甚至可能早于NAFLD和T2D的发展。越来越多的胃肠道和代谢疾病已对肠道微生物组进行了研究(表1)。
肠道微生物和代谢紊乱:分子因素
肠道菌群在代谢紊乱的多个方面的调节中起着重要作用。除其他因素外,这种调节取决于微生物群产生的各种代谢物,以及它们与宿主细胞上受体的相互作用,这些受体可以激活或抑制信号通路,对宿主的健康有益或有害(图2)。
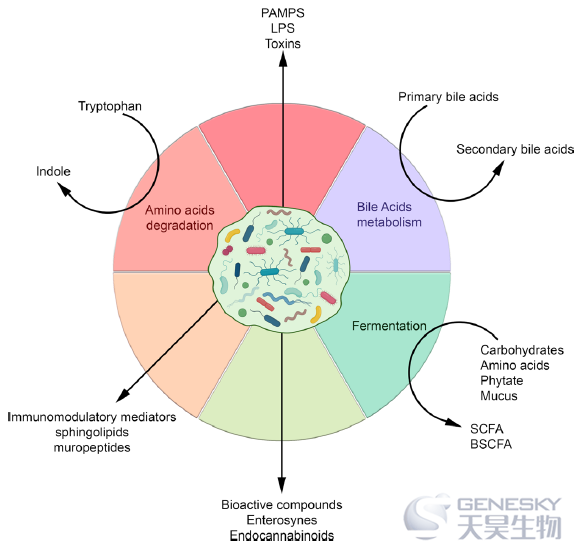
图2、由肠道菌群产生的分子和代谢物。BSCFA,分支短链脂肪酸;PAMPs,病原体相关分子模式;SCFA,短链脂肪酸。
参与这些相互作用的细菌代谢物非常多样,从小分子到大分子都有。它们包括细菌代谢的副产物,如SCFAs,以及细菌完整性所必需的复杂大分子,如肽聚糖和脂多糖(LPS)(图2)。这些代谢物的丰度和可用性取决于微生物组成,因此受饮食和环境因素的影响。主要分子因素如下所述:
短链脂肪酸及其对宿主健康的影响:分子机制
小肠在营养物质的分解、乳化和吸收方面高度专业化,很少有营养物质会逃脱消化。例如,在正常情况下,< 5g/天的脂肪将到达结肠。同样的原理也适用于简单碳水化合物(分解为糖分子)和大多数蛋白质(转化为氨基酸)的消化和吸收,尽管根据摄入的水平,一些蛋白质会到达结肠。相反,复杂的碳水化合物,如膳食纤维,是不可消化的,这意味着身体缺乏必要的酶来消化它们,使它们在小肠中逃脱消化。然而,在结肠中,它们可以被特定的常驻细菌用作能量来源。各种肠道微生物将有助于这些不可消化的碳水化合物代谢成不同的SCFAs分子(如乙酸盐、丁酸盐和丙酸盐)。SCFAs的化学特性良好,其对健康的影响已被广泛记录。这些化合物调节肠道内和远处的许多代谢途径,如肝脏、脂肪组织、肌肉和大脑(图3)。现在,已知这些微生物代谢物有助于许多生理效应,包括调节能量稳态、葡萄糖/脂质代谢、炎症,甚至免疫和癌症。
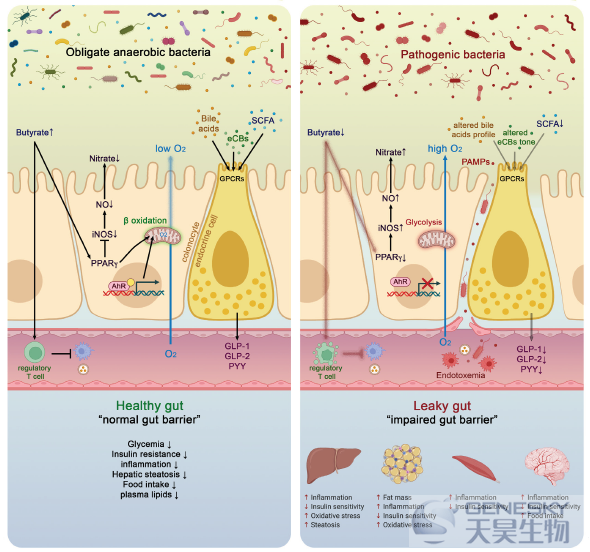
图3、健康和疾病状态下肠道菌群和宿主健康互作分子机制。在健康情况下,结肠细胞通过线粒体中的β-氧化作用使用丁酸盐作为能量底物,从而消耗氧气并直接有助于维持管腔中的无氧条件。丁酸盐还与过氧化物酶体增殖物激活受体γ(PPARγ)结合,进而抑制诱导型一氧化氮合酶(iNOS),减少一氧化氮生成(NO)并最终减少硝酸盐生成。相反,在病理情况下,管腔中低丁酸盐含量与PPARγ活性降低、糖酵解增加和氧消耗降低有关。这与iNOS的高表达有关,这反过来产生更多的NO,并最终增加特定病原体对硝酸盐的利用。丁酸盐还可以刺激免疫细胞,如调节性T细胞(Treg)以减轻炎症。核转录因子芳香烃受体(AhR)在健康的结肠细胞中高度表达和激活,而AhR的激动剂是低的或者降低的AhR活性可以导致肠屏障功能的改变。肠内分泌细胞(L细胞)表达由短链脂肪酸(SCFAs)、特异性内源性大麻素(ECB)和胆汁酸(BAs)激活的几种关键受体。激活这些受体会增加关键肠道肽的分泌,如胰高血糖素样肽(GLP)-1、GLP-2和YY肽(PYY)。总之,肠道微生物和这些分子因子之间的相互作用有助于降低肠道通透性,改善胰岛素分泌和胰岛素敏感性,减少食物摄入,降低血浆脂质,并避免肝脂肪变性和代谢性内毒素血症。所有这些效应都与炎症降低有关。相反,在病理情况下观察到相反的效果。
由于一系列的实验研究,富含可发酵膳食纤维(如益生元)的饮食能够减少体重增加、脂肪量发展、胰岛素抵抗和能量摄入。其中,发现使用益生元调节肠道菌群导致由L细胞产生的几种肠道肽(如GLP-1、GLP-2和YY肽(PYY))的更高的内源性产量(即mRNA和肽)和门静脉分泌(图3)。这些影响不仅限于一种可发酵碳水化合物,因为抗性淀粉或阿拉伯木聚糖微生物发酵为SCFA会产生与血浆GLP-1和PYY水平增加相关的类似生理影响。然而,可发酵纤维的化学结构与SCFA生产模式直接相关,因为生成的丁酸盐、乙酸盐或丙酸盐的数量取决于纤维的类型。例如,菊粉被描述为产丙酸,而抗性淀粉更产丁酸。值得注意的是,一些结肠细菌也使用替代途径从氨基酸(如赖氨酸)产生丁酸,或从植物化合物(如肌醇六磷酸)产生丙酸。值得注意的是,SCFAs的来源来自饮食,它们可以通过覆盖肠上皮细胞的肠粘液的发酵来自宿主本身。
SCFAs通过作用于在回肠末端和结肠中特别丰富的肠内分泌L细胞表面表达的特定G蛋白偶联受体来刺激肠肽的分泌。这些受体被命名为G蛋白偶联受体(GPR)43(或游离脂肪酸受体2 (FFAR2))和GPR41(或FFAR3)(图4),也在多种组织和细胞类型(如脂肪细胞、免疫细胞)中表达。通过使用缺失GPR43或GPR41的小鼠模型,已经阐明了微生物组在肠道肽分泌中发挥的关键作用。缺乏这些受体的小鼠在暴露于SCFAs或特定益生元后,表现出GLP-1和PYY分泌减少(图3)。
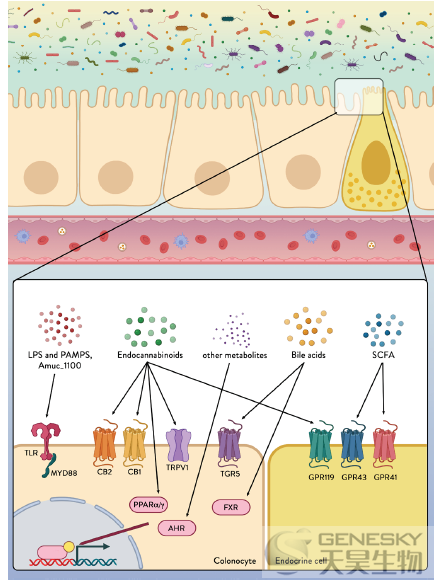
图4、结肠细胞和内分泌细胞表达多种能够感知和传递来自微生物环境的信号的受体。通过模式识别受体,包括toll样受体(TLRs),检测来自微生物群的微生物/病原体相关分子模式(PAMPs)和脂多糖(LPS)。Amuc_1100是一种表达在粘蛋白嗜酸细胞外膜上的蛋白质,已经表明其通过TLR2发出信号以改善肠道屏障功能并减少炎症。某些微生物(如内源性大麻素(ECB))分泌的代谢物、微生物消化食物成分(如短链脂肪酸(SCFAs))或宿主衍生因子(如ECB和胆汁酸)转化产生的代谢物可通过各种受体和途径被感知,从而改变肠道完整性和宿主健康。CB1、CB2、大麻素受体1型和2型;TRPV1,瞬时受体电位阳离子通道亚家族V成员1;FXR,法尼基X受体;芳香烃受体;GPR119、GPR43、GPR41、G蛋白偶联受体119、43和41;MYD88,髓系分化初级反应88;PPARα/γ,过氧化物酶体增殖物激活受体α和γ;TGR5,武田G蛋白偶联受体5。
除了众所周知的作用和机制,一些SCFAs还可能发挥不同于以前所认为的功能。例如,丁酸盐被多次描述为结肠细胞增殖和维持肠道屏障的必需能源。然而,最近的证据表明,丁酸盐也通过与结肠细胞沟通而强烈影响微生物环境。事实上,肠道内腔部分的氧气含量丰富,且其浓度朝着上皮逐渐降低,这是厌氧菌保持在上皮附近的关键要求,而兼性厌氧菌如肠杆菌科(变形菌门)已被证明会增加肠道炎症的风险(图3)。丁酸盐通过激活线粒体中的β-氧化,有助于控制结肠中的厌氧条件。通过激活结肠细胞中的核受体过氧化物酶体增殖物激活受体γ(PPARγ),丁酸盐限制了氧从结肠细胞向管腔部分的扩散,从而维持了无氧条件。PPARγ的激活也抑制了编码诱导型一氧化氮合酶的基因的表达,从而减少了NO的产生,并最终降低了管腔硝酸盐的水平,而管腔硝酸盐是推定的致病兼性厌氧菌(肠杆菌科)增殖的特定能源(图3)。在患有严重肠道炎症的人类中进行了类似的观察,例如在IBD、癌症、肥胖症和糖尿病期间,其中检测到肠杆菌科的丰度增加。
引人注目的是,许多论文指出,所有这些疾病都与产生SCFAs的细菌(主要是丙酸和丁酸)数量减少有关。例如F. prausnitzii、A. muciniphila和最近的Dysosmobacter welbionis就是这种情况。厌氧消化菌和厌氧丁酸菌是一个特殊的例子,它们利用乙酰辅酶a途径在乙酸存在的情况下从乳酸生成丁酸。它们可以在小肠和结肠中形成营养链,在结肠中各种细菌产生乳酸乳酸(一种不需要的酸)在肠道环境中的积累会导致胃肠功能紊乱,这可能解释了代谢综合征受试者中使用产丁酸梭状芽孢杆菌进行干预的一些益处。
除了丙酸盐和丁酸盐,琥珀酸盐的影响也在研究中。众所周知,琥珀酸是三羧酸循环的中间产物,被认为是线粒体氧化磷酸化的底物,但也是细菌的代谢产物。在这种情况下,琥珀酸酯通常被忽略,因为它被认为是丙酸酯合成中的主要关键中间体。目前,琥珀酸的作用在很大程度上仍然是一个有争议的问题,因为有报道称琥珀酸与胰岛素抵抗、肥胖和炎症之间存在有利和不利的联系。
脂多糖/病原体相关分子模式
肠道屏障是一个复杂和动态的物理和化学结构的集合,它监视环境并保护宿主免受微生物入侵和有害刺激。这些来自环境的有害成分中有一些是所谓的病原体相关分子模式(PAMPs ),其中细菌脂多糖是典型的一类。
在革兰氏阴性细菌的细胞膜上发现的内毒素LPS是炎症反应的有效激活剂,即使少量LPS释放到循环中也足以引发炎症反应。LPS和其他PAMPs通过激活特定的模式识别受体(PRRs)发挥其活性,所述受体感知微生物和感染因子并发出防御反应信号。PRRs有四个主要的亚家族:toll样受体(TLRs)、含核苷酸结合寡聚化结构域-富含亮氨酸重复序列(LRR)的受体、视黄酸诱导基因1(RIG-1)样受体(又名RIG-1样解旋酶)和C型凝集素受体。在这些受体中,TLRs是一个受体家族,在人类中有10个成员(在小鼠中有13个成员),其特征最明显。每种TLRs介导对来自病原体的不同微生物成分的反应。两个典型的例子是感知细菌脂蛋白的TLR2和识别细菌LPS的TLR4。TLR涵盖了大范围的外部刺激(PAMPs)和来自组织损伤的内部信号(损伤相关分子模式(DAMPs)(图3和4)。这些配体有多种形式和大小:从核酸到脂质,从小分子化合物到大分子。TLR广泛分布于免疫细胞中,包括巨噬细胞、嗜中性粒细胞、树突细胞、自然杀伤细胞、肥大细胞、嗜碱性粒细胞和嗜酸性粒细胞,但也分布于其他体细胞中,如肠上皮细胞。它们的激活诱导抗原呈递细胞激活,从而桥接先天和获得性免疫反应,并刺激信号级联,试图抵御微生物入侵或修复受损组织。尽管这种炎症反应是消除感染所必需的,但TLRs的过度激活可导致免疫稳态的破坏,并且持续的促炎细胞因子和趋化因子的产生可增加炎性疾病和自身免疫性疾病的风险。代谢性内毒素血症就是这种情况,在代谢性内毒素血症中,高脂肪饮食和体重增加与较高的肠道渗透性和随后循环血浆LPS的全身性(轻度)升高有关。这导致了低度炎症状态,这是一系列慢性疾病的病理特征,包括T2D、NAFLD、慢性肾病和动脉粥样硬化。有趣的是,不同类型细菌的LPS对肠道屏障功能、脂肪炎症、肠道葡萄糖吸收、血糖、胰岛素和肠促胰岛素,表明代谢性内毒素血症水平对宿主代谢的净影响可能因肠道菌群组成的功能而异。PRRs表达的破坏与有利于炎症的微生物群组成的改变有关。例如,缺乏由细菌鞭毛蛋白激活的TLR5的小鼠会出现结肠炎或代谢综合征,并伴有微生物群的改变。下游信号通路的TLR激活已被证明依赖于髓样分化因子88蛋白(MyD88)(图4)。MyD88是除TLR3106之外的所有TLR的必需衔接蛋白,在肠道中删除MyD88可部分防止饮食诱导的肥胖、糖尿病和炎症,并增加抗炎性内源性大麻素(ECB),恢复抗菌肽的产生,并在饮食诱导的肥胖期间增加肠道调节性T细胞。
生物活性脂质
主要的BAs,如人体内的胆酸(CA)和鹅去氧胆酸(CDCA)(以及啮齿动物体内的鼠胆酸(MCA)),是在肝脏内由胆固醇合成的两亲性分子。在分泌到胆汁和储存在胆囊内之前,它们可以与甘氨酸或牛磺酸结合。当食物被摄入时,BAs被释放到小肠中,在那里它们帮助消化和吸收膳食脂肪。大约95%的肠道BAs在回肠被重吸收,返回肝脏重新分泌。BAs的这种肠肝循环每天发生几次,是维持全身葡萄糖、脂质和能量稳态的重要生理机制,以防止高血糖、血脂异常和肥胖,并防止消化系统和心血管系统的炎症性代谢疾病。
虽然BAs的主要功能是调节胆固醇、甘油三酯和脂溶性维生素的消化和吸收,但最近人们认识到,BAs还具有内分泌功能,因为它们充当信号分子。初级细菌易受肠道微生物的影响。这些修饰包括通过胆汁盐水解酶(BSH)活性进行解偶联(去除氨基酸残基),以及通过去除羟基(脱羟基)、氧化(脱氢)或差向异构化进行进一步代谢。这导致了次级BA的形成,如脱氧胆酸、石胆酸和熊去氧胆酸(人类的次级BA,尽管啮齿动物的初级BA)。这种细菌代谢改变了BAs的生物利用度和生物活性,从而改变了其对所涉及的代谢反应的影响。由于BAs具有信号传导能力,并且通过肠道菌群进行化学转化,因此BAs可被视为微生物群衍生的信号代谢物。
芳香烃受体(AhR)在脊椎动物细胞中普遍表达,这种转录因子在配体结合后被激活。细菌产物和代谢物作为激活剂发挥着关键作用,过去几年的研究试图弄清楚AhR与肠道菌群的相互作用(图3和4)。研究表明,通过施用乳杆菌菌株实现的AhR配体增加改善了代谢功能,同时改善了肠道屏障并减少了肝脂肪变性。在实验性酒精性肝病中,肠道菌群严重受损的疾病,诱导AhR配体和施用6-甲酰基吲哚(3,2-b)咔唑(Ficz)改善了酒精性肝病。AhR途径还可能对其他炎症性胃肠疾病(如乳糜泻)有重大影响。
除了经典分子如SCFAs、BAs或PAMPs和肠肽(即GLP-1、PYY)之外,所有这些分子都被描述为宿主代谢、肠屏障和炎症的调节剂,一类称为“enterosynes”的新型分子的作用正在显现。最近引入了enterosynes的概念,并将其定义为“源自肠道的分子,其具有通过靶向肠神经系统(ENS)来调节十二指肠收缩的能力”。肠球菌在化学成分上具有多样性,并与激素、生物活性肽/脂质、营养物质、微生物群和免疫因子相关。
在寻找参与葡萄糖代谢的新肠道分子和受体的过程中,研究也探索了已知改变肠道菌群和改善糖尿病的特定纤维的作用。通过使用脂质组学分析,发现低聚果糖喂养选择性地增加了结肠细胞中肠生物活性脂质(12-羟基二十碳四烯酸(12-HETE))的丰度。引人注目的是,给予糖尿病小鼠12-HETE改善了葡萄糖代谢。12-HETE的作用也在体外得到了证实。
结论和展望
在过去二十年里,在肠道菌群与健康领域研究者已经取得了相当大的进展。肠道菌群和健康领域正在发展到无可辩驳的因果联系。然而,仍然有大量的研究声称因果关系,而事实上只有相关性被证明。从相关性转向因果关系仍然是一个重要且必需的步骤,以更好地设计基于肠道菌群调节或通过使用特定活性化合物的假定干预措施。由于组学分析的大量努力和进步,科学界正逐步转向个性化药物,微生物群时代显然是未来医学和营养方法转变的重要组成部分。
-END-
天昊生物微生物测序相关链接:
开工大吉,好文读起!《Microbiome》宏基因组 + RNA-seq + 代谢组联合分析揭示糖尿病患者饮食与菌群及免疫关系;
祝贺!天昊微生物扩增子和基因组学联合分析助力客户骨质疏松研究见刊一区杂志《Frontiers in Microbiology》;
祝贺!天昊客户利用16S扩增子测序研究杏鲍菇多糖发酵特性,文章登陆食品科学领域一区期刊《Food Chemistry》;

创新基因科技,成就科学梦想