当利用宏基因组测序研究人类肠道微生物时,我们可以获得许多差异功能分析结果。其中一项就是利用CAZy数据库进行的统计分析数据。CAZy数据库是关于能够合成或者分解复杂碳水化合物和糖复合物的酶类的一个数据库资源,其基于蛋白质结构域中的氨基酸序列相似性,将碳水化合物活性酶类归入不同蛋白质家族。那么关于人类肠道菌群中的碳水化合物活性酶(CAZymes)目前的研究进展以及应用方向如何呢?今年3月的一篇Nature Reviews综述文章给我们进行了很好的总结。
我们知道人类肠道中存在着大约1013 ~ 1014的微生物,其基因组的很大一部分用于编码碳水化合物的降解和摄取相关酶类,表明这类分子具有重要的作用。碳水化合物的功能不仅是作为这些细菌的碳源,也是附着于宿主的一种方式,以及宿主感染的一种屏障。在这篇综述中,作者重点介绍了碳水化合物活性酶(CAZymes)的多样性,肠道微生物如何利用它们降解碳水化合物,这些CAZymes的不同化学机制,以及这些微生物及其CAZymes在人类健康和疾病中的作用。本文还重点介绍了这些酶类如何用于控制菌群来改善健康和治疗疾病,以及用于改造生物制药上的聚糖和用于生产通用型血液的可能性。

英文题目:Carbohydrate- active enzymes (CAZymes) in the gut microbiome
中文题目:肠道菌群中的碳水化合物活性酶(CAZymes)
期刊名:Nature Reviews | Microbiology
人类与微生物有着密切的关系。我们肠道中的细菌群落因其在人类健康和生理学中的许多作用而被重点研究,这些作用包括免疫系统发育、营养摄取、药物代谢和宿主行为的调节等。碳水化合物在塑造微生物群落方面有着重要的作用。肠道是微生物的竞争环境,降解碳水化合物(无论是食物中的还是来自宿主或肠道菌群的)的能力为某些细菌提供了竞争优势。微生物碳水化合物降解活性也为宿主提供了实质性的益处。人类缺乏降解膳食碳水化合物所必需的大多数酶,我们将这些酶的需求外包给我们固有的肠道细菌。虽然细菌降解这些碳水化合物来满足自己的需求,但作为回报,宿主获得了以短链脂肪酸的形式的能量,通常高达身体能量的10%。短链脂肪酸还具有抗炎活性,可以调节表观遗传重塑并影响宿主代谢。在很大程度上,碳水化合物、微生物群和人类健康之间的相互作用平稳地进行,但偶尔也会变得明显。一个例子就是肠胃气胀通过结肠产气细菌对豆类、芸苔属和乳制品中存在的膳食低聚糖的过度厌氧发酵。
碳水化合物活性酶(CAZymes)作用于多种底物。几个不同的酶类和相关模块包括在CAZy数据库以及相关联的CAZypedia(图1)。参与碳水化合物降解的酶包括糖苷水解酶、多糖裂解酶和碳水化合物酯酶。此外,辅助活性酶进行各种氧化还原转化,这在许多情况下是降解性的。酶的种类和所用的化学机制高度依赖于被裂解的碳水化合物底物的结构。由肠道的厌氧环境和许多辅助活性酶的氧依赖性造成的另一个限制是辅助活性酶似乎没有在人类肠道微生物组中广泛编码。同时,参与碳水化合物合成的主要酶被归为甘氨酸糖基转移酶。通常,CAZyme被附加上碳水化合物结合模块(CBMs),其在增强附加CAZyme的催化活性中具有重要作用,但自身不包含催化活性。
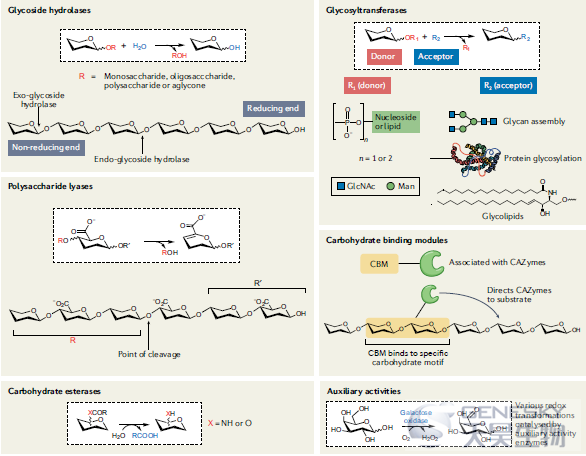
图1、CAZyme类和相关模块概述。糖苷水解酶(Glycoside hydrolases)催化多种碳水化合物底物中糖苷键的水解,根据其在碳水化合物底物中的裂解位置,可分为外切糖苷水解酶或内切糖苷水解酶。糖基转移酶(Glycosyltransferases)利用活化的供体形成糖苷键,将糖转移到特定的受体如蛋白质、脂质或其他聚糖上。多糖裂解酶(Polysaccharide lyases)利用一种独特的机制来分解含有糖醛酸的多糖。糖胺聚糖是在人类肠道微生物群中最常遇到的多糖裂解酶底物。碳水化合物结合模块(Carbohydrate-binding modules, CBMs)是没有催化活性的结构域,通常附加在碳水化合物活性酶(CAZymes)上。CBM结合一系列不同大小和组成的碳水化合物基序,并有助于将相关的CAZyme导向底物。碳水化合物酯酶(Carbohydrate esterases)催化各种碳水化合物底物的去酯化。辅助活性酶(Auxiliary activity enzymes)包括一大类作用于碳水化合物的氧化还原活性酶。
因为特定CAZymes的进化和获得为某些细菌提供了竞争优势,所以人类肠道细菌将其基因组的大部分贡献给了CAZymes。糖苷水解酶是负责碳水化合物降解的最大和研究得最好的一类CAZymes。尽管它们具有广泛的底物范围、不同的三维结构和进化起源,但大多数糖苷水解酶使用两种化学机制中的一种,这两种机制是由Koshland在大约70年前基于对酸催化糖苷水解的共同理解而首次提出的(方框1)。然而,这些机制有一些耐人寻味的适应,以匹配底物结构的特性。因此,肠道微生物组中CAZymes的丰富性和多样性使得肠道成为CAZyme发现的起点。宏基因组测序显示,人类肠道微生物群整体上是地球上所有环境中每千碱基糖苷水解酶密度最高的。因此,肠道菌群如多形拟杆菌和卵形拟杆菌将其基因组中显著的比例用于糖苷水解酶和多糖裂解酶(约6%的基因被编码,而大多数生物将其1-3%的基因用于CAZymes)。特别是,参与膳食多糖和人类聚糖降解的CAZymes可能特别丰富。利用这一资源,酶参与了高价值生物药物的制备,甚至是血型改造,已经从肠道微生物群中鉴定出来。
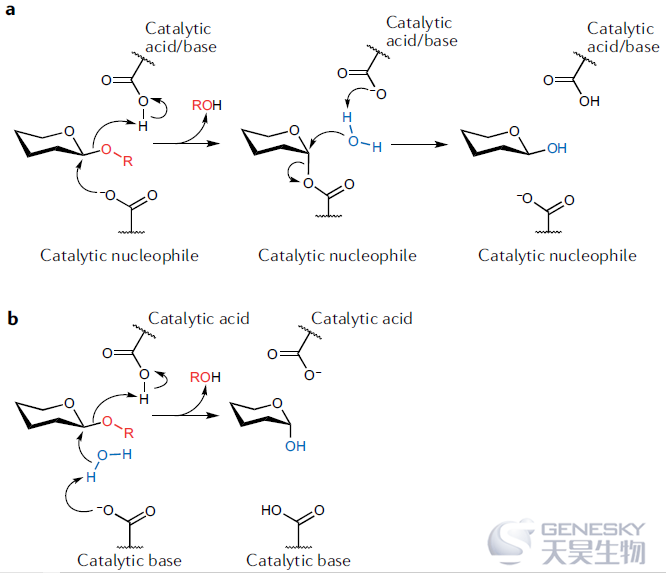
方框1 |经典的Koshland机制
淀粉和纤维素中的糖苷键是自然界中最稳定的化学键。幸运的是,大自然在进化糖苷水解酶来水解这种连接方面做了出色的工作。在一篇开创性的论文中,Daniel Koshland Jr根据异头中心的立体化学在水解时是保留还是转化,提出糖苷水解酶可以遵循的两种机制。如图a所示,糖苷键的断裂可以通过两步双置换机制实现,同时保留了立体化学。第一步涉及两个催化残基(通常是Asp或Glu)以协同方式起作用。一个残基充当亲核试剂,攻击异头中心,而另一个残基给离去的离去基团贡献一个质子。接下来,当酸或碱残基攻击糖基酶并释放糖产物时水去质子化。或者,糖苷水解酶可以通过立体化学转化的单一置换机制进行(图b) 。一个羧酸残基质子化糖苷氧,而另一个残基辅助用于异头取代基直接置换的水亲核试剂的去质子化。所有的步骤都是通过类氧碳正离子过渡态进行的。尽管糖苷水解酶大部分遵循上述机制,但也有偏离的报道,其中一些在本文中有所描述。对于感兴趣的读者来说,CAZypedia提供了与碳水化合物活性酶(CAZymes)和碳水化合物相关的机制、历史和其他概念的清晰和有用的描述。
这篇综述将集中在酶的酶学基础,细菌碳水化合物降解的共同主题(特别是研究充分的拟杆菌门)以及这些酶在人体肠道微生物群分解碳水化合物中的生理作用。此外,通过讨论这些CAZymes的化学机制,以及它们的应用,我们旨在提供一个独特的视角进入该领域。此类工作将突出我们对人类肠道微生物群的基本糖生物学的理解与我们对CAZyme机制的知识相结合的重要性,从而在医学和生物技术方面取得进一步的进展。
在不同的文化和饮食习惯中,人类肠道内的微生物组成和相关的钙调素复合体是专门针对膳食多糖的。此外,饮食和微生物组的组成和功能之间的关系也存在于其他动物物种中。微生物在肠道中定居的方法之一是进化出能够降解特定多糖的酶。因此,不同类型的细菌具有不同的CAZyme含量。通常在人类中,富含植物性碳水化合物饮食的肠道中富含普雷沃氏菌,而较少碳水化合物饮食使得拟杆菌属含量更丰富。然而,基因组含量的物种水平和菌株水平差异以及其他饮食因素也影响肠道中的微生物丰度。
不同膳食碳水化合物的引入在不同的时间尺度上驱动微生物组和相关的CAZyme组成的变化。例如,在饮食改变的一天内,观察到常驻微生物多样性和代谢的微小变化,以及来自新食物来源的代谢活性细菌的引入。哈扎狩猎采集者的饮食经历着季节性变化,他们在旱季选择富含肉类的饮食,在雨季选择富含蜂蜜和浆果的饮食。这些饮食的变化导致微生物组成的变化(例如,在雨季普雷沃氏菌属的减少)和相关的CAZyme丰度的增加。值得注意的是,相比之下,工业化国家的成年人通常具有相对稳定的微生物群。这种稳定性被认为是由一致的(并且经常是低纤维的)饮食所驱动的,这种饮食导致原本易变的细菌群体的消失,伴随着细菌多样性的整体丧失。作为对长期饮食习惯的一种适应,共生生物也能经历基因组水平的变化。
肠道细菌已经进化出许多降解食物中碳水化合物的方法。这些通常来自植物的碳水化合物被称为膳食纤维,它们不会被宿主降解,而却被人体肠道微生物群所作用。淀粉就其在肠道微生物群中的作用而言,是研究得最多的纤维之一。然而,根据食物的制备和淀粉的性质,2%到50%的淀粉可以逃脱宿主的降解,并被传输给肠道菌群。淀粉在肠道微生物中的降解和吸收的不同途径已经被研究。最著名的是芽孢杆菌中的淀粉利用系统(Sus)。八基因多糖利用基因座(PUL)提供了一个通用的模型,该模型已经扩展到整个拟杆菌门的其他物种。在某些情况下,这种降解方法被认为是“自私的”,因为它已将营养分配给邻近的肠道微生物的可能性降到了最低。一般来说,多糖的降解是由多糖的细胞外裂解引发的。这就产生了大量的寡糖,然后这些寡糖被迅速转运到周质中,在那里寡糖被分解成简单的单糖和二糖。这个过程有效地阻止了其他细菌吸收任何释放的碳水化合物。在其他实例中,降解产物不会被快速转运到周质中,而是可以与其他细菌共享。
自私模型首先由Cuskin等人提出,用于描述多形拟杆菌对酵母α甘露聚糖的降解。几个世纪以来,含酵母的发酵食品一直是人类饮食的一部分。因此,像多形拟杆菌这样的肠道细菌进化出消化酵母细胞壁的方法就不足为奇了。α甘露聚糖降解由BT3862启动,BT3862是一种负责释放双糖的内切α-1,2-甘露糖苷酶(GH99)(图2)。通过环氧化物中间体进行的新型底物辅助催化机理是最近为GH99家族提出的,并得到了完善的机理研究的支持。
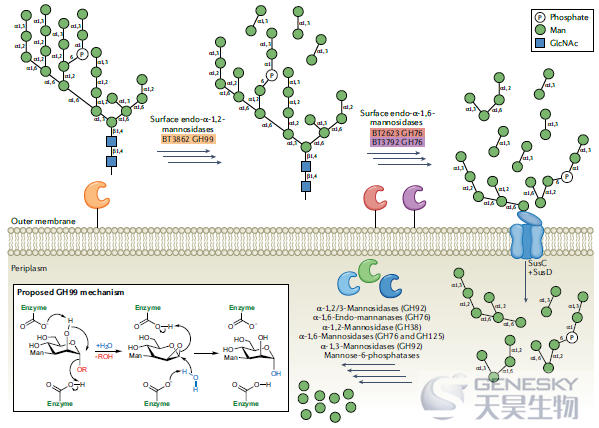
图2、多形拟杆菌消化α-甘露聚糖的机制。Cuskin等人首先描述了多形拟杆菌进行的降解概述。简而言之,几种细胞表面定位的碳水化合物活性酶(CAZymes)在外膜上启动α-甘露聚糖的降解。然后SusC/D样蛋白将寡糖导入周质。运输到周质后,各种酶进行完全降解。
必须指出的是,并非人类肠道微生物群中所有的碳水化合物降解都是自私的。事实上,复杂的碳水化合物交叉进食网络似乎在微生物群落中很常见。在许多情况下,与碳水化合物降解的细菌的共培养能够使原本不能利用碳水化合物的菌株生长(次级降解菌)。在许多情况下,次级降解菌似乎只是缺乏负责初始裂解的表面内切糖苷水解酶,因为外源添加这些酶或整合所需基因能够利用碳水化合物。
更复杂的碳水化合物的降解需要更大的多聚糖利用位点(PULs),包含更广泛的酶类。一个最复杂的例子是鼠李半乳糖醛酸聚糖II (RG II)的降解,这是一种果胶中常见的多糖。RG II中总共有21个不同的糖苷键,具有许多酯修饰、吡喃糖和呋喃糖。多形拟杆菌利用包含在三个PULs中的多种酶对这种碳水化合物进行几乎完全的降解。事实上,似乎许多碳水化合物的同源PULs的存在可以作为聚糖降解能力的相对可靠的指标。此外,不同细菌中同源PULs的存在可能为人类肠道微生物群提供一定水平的功能稳定性,因为即使某一种聚糖降解物丢失,另一种也能够发挥相同的作用。
PUL的存在也表明存在能够被降解的多聚糖。最近,Lapébie等人扩展了这一概念,将自然界中存在的碳水化合物结构的总数估计为几千个。Lapébie等人主要是通过测量迄今为止不同排序的PULs数量估计的。然而,这种”一个PUL,一个多聚糖”的模式存在其复杂性。越来越复杂的碳水化合物通常需要在中央PULs之外额外的共调节基因簇,称为CAZyme簇才能被完全降解。在其他情况下,不同的PUL将靶向不同的多聚糖。在这种情况下,某些生物可能只含有其中一些PULs,很可能只有通过交叉作用才能实现进一步的碳水化合物降解。
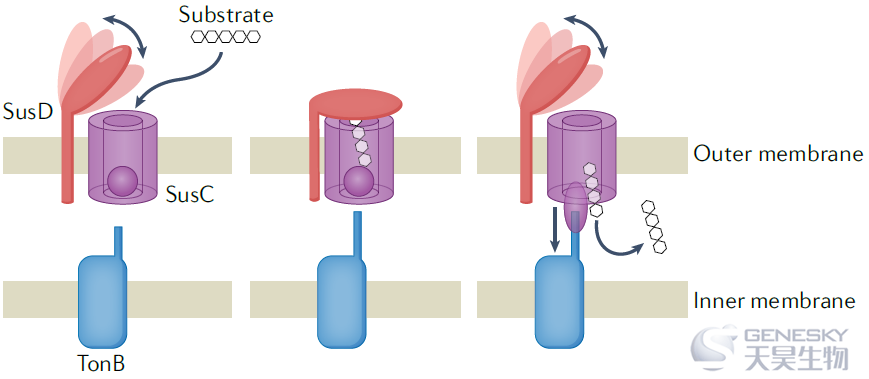
方框2 | SusC和SusD:定义多聚糖利用位点
多聚糖利用位点(PUL)是编码碳水化合物活性酶(CAZymes)、聚糖结合蛋白、转运蛋白以及碳水化合物结合、切割和运输所需的受体和调节因子的基因座。在基因座内,SusC是一种外膜TonB依赖转运蛋白,而SusD是一种表面多聚糖结合蛋白。SusC和SusD对于PUL功能都是至关重要,去除其中任何一个都会导致PUL功能的显著降低。因此,这两种基因的存在是革兰氏阴性PULs的典型标志。最近的结构表征表明SusC和SusD在膜中结合。在被称为“踏板箱”的模型中,在没有底物的情况下,SusD充当SusC上的柔性铰链盖,暴露SusC中的结合位点。一旦底物在SusC内结合,SusD盖关闭,底物以TonB依赖的方式通过SusC进入周质。最近,PUL的定义已经扩展到包括革兰氏阳性菌这类缺乏SusC/D对的类似基因簇。
在宿主和微生物之间的界面上,覆盖着肠腔的是一层粘液。这种粘膜层的主要成分是一种称为粘蛋白的蛋白质家族,它被O聚糖和少量N聚糖高度糖基化。从人类的角度来看,厚厚的粘液层起到了抵御细菌的屏障作用。从细菌的角度来看,它的功能是作为附着点来维持它们在流动的胃肠道中的位置,以及作为一种营养来源,尤其是在饮食碳水化合物有限的时候。事实上,对微生物群和以粘液层为中心的宿主之间的相互作用仍然知之甚少。
粘膜碳水化合物结构的复杂性,包括许多不同的单糖组分、糖苷键和修饰,可能是细菌穿透粘液的重要障碍。尽管如此,一些细菌确实做到了这一点,通常是通过分布在许多糖苷水解酶家族中的大量酶以及辅助酶如硫酸酯酶来实现的(图3a,b)。相比之下,进化成易于降解的膳食多糖如淀粉不太复杂,需要较少的酶来协同降解。甚至特殊大小的粘蛋白降解物也常常靶向相对较少的结构,也许是为了限制基因组维持和酶表达的能量消耗。有趣的是,粘蛋白的N-聚糖和O-聚糖共享某些结构基序,这些基序有助于被相同的酶分解,并诱导相同的PULs。似乎只有在最初切割这些延伸的修饰并转运穿过外膜后,周质的酶才能去除这些修饰。
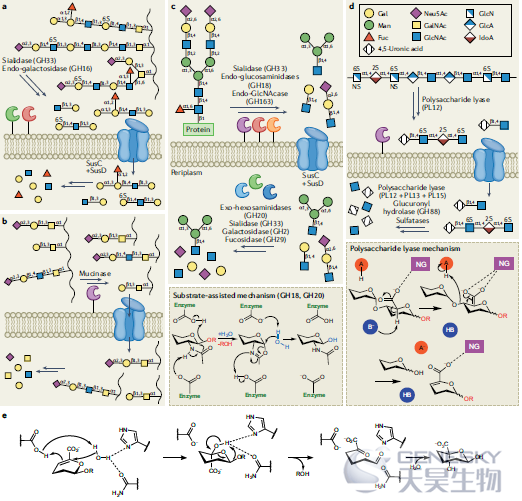
图3、多形拟杆菌对宿主聚糖的降解。a, b)糖苷水解酶GH16家族内半乳糖苷酶(a部分)或者粘蛋白酶(b部分)可以通过产生大的寡糖或糖肽以供摄取和进一步解聚。c)来自多形拟杆菌的一系列碳水化合物活性酶(CAZymes)催化复杂N-聚糖的分解(上图)。GH18和GH20系列使用的底物辅助机制(下图)。d)糖胺聚糖硫酸乙酰肝素的降解(上图)。多糖裂解酶的作用机制(底部)。e)GH88和GH105家族在加工由多糖裂解酶产生的不饱和寡糖时的简化机制。
越来越多研究表明,肠道微生物群落在药物代谢中具有重要作用。为了钝化和激活某些异生素和内生素的溶解度,人糖基转移酶1 (GT1) UDP葡萄糖醛酸转移酶通过单个SN2置换将β葡萄糖醛酸部分共价连接到小分子可用的OH、NH或SH(甚至活化的CH)官能团上(图4)。这些葡糖苷酸然后被排泄到胃肠道中进行处理。然而,某些肠道细菌可以利用这些葡萄糖醛酸苷作为碳源,通过使用β葡萄糖醛酸苷酶(GUSs)(主要是CAZy家族GH2)来释放葡萄糖醛酸,从而重新激活该化合物。在许多情况下,这种反应已被证明会导致毒性作用,一个显著的例子是使用伊立替康治疗癌症引起的严重腹泻。
肠道微生物群中GUS酶的结构特征和活性分析揭示了对活性和底物范围有明显影响的不同活性位点结构。识别重新激活的结合药物的特定酶和开发特异性抑制剂,可以与那些药物共同给药以选择性地关闭它们的重新激活,从而减轻副作用。这些GUS酶的不同活性位点结构为设计选择性抑制剂提供了希望。
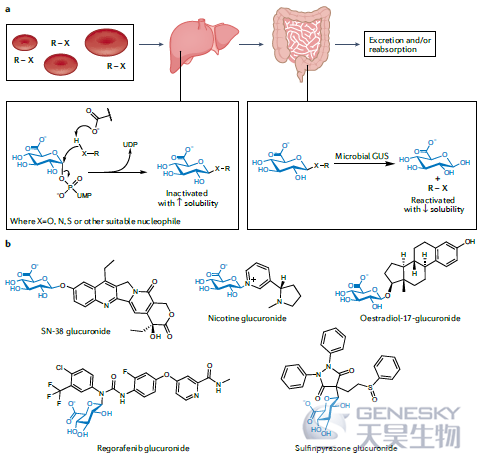
图4、小分子的葡萄糖醛酸化和细菌GUSs的再活化。a)在肝脏中,人类UDP-葡萄糖醛酸转移酶通过葡萄糖醛酸化使小分子失活。在大肠中,微生物β-葡萄糖醛酸酶(GUSs)可以重新激活这些化合物。b)选择已知为葡萄糖醛酸化的分子。
大多数病原体不能与驻留的微生物竞争它们的碳水化合物食物源,因此在正常情况下病原体可以被有效地排除在肠道之外。因此,肠道生态系统的破坏似乎在致病菌的建立中起着重要的作用。例如,抗生素治疗破坏了粘蛋白降解者和非粘蛋白降解者之间的交叉进食网络,并允许致病细菌如鼠伤寒沙门氏菌和艰难梭菌的增殖。在这种情况下,缺乏宿主聚糖降解酶的病原体将捕获由宿主释放的游离单糖。引入新的生态位也会导致生态失调。
尽管大多数共生细菌被转移到外粘膜层,但在感染期间,病原体必须经常穿过粘膜屏障。为此,细菌和病毒病原体表达糖苷水解酶,分解肠道和气道中的粘膜聚糖。通常有助于这一过程的是微生物粘附素、凝集素和CBMs,它们赋予细菌附着于粘膜的能力。微生物也可以利用宿主表达的具有凝集素活性的蛋白质。在感染过程中,许多CAZymes参与逃避宿主免疫反应。也许这方面最著名的例子是糖基转移酶,它合成宿主聚糖模拟结构,以帮助病原体逃避作为非自身的检测。特别是,病原体上唾液酸的存在经常有助于欺骗免疫系统。参与免疫反应的分子的酶促分解是致病原使用的另一种策略。血清中用作能量来源的N聚糖的降解也显示出在感染期间为脆弱类杆菌提供营养。
来自人类肠道菌群的糖基转移酶是生物学中有价值的工具。与它们的真核对应物相比,细菌糖基转移酶通常更容易在大肠杆菌中表达,并且没有如此严格的底物要求。此外,由于许多细菌合成模拟人类糖基化的多糖(以逃避免疫),细菌糖基转移酶可用于合成具有真核糖基化模式的糖蛋白。例如,细菌唾液酸转移酶能够产生半衰期延长的治疗性糖蛋白。
细菌寡糖基转移酶是一类具有重要生物医学应用的酶。在生理学上,这些酶负责在许多病原体中将脂质连接的寡糖整体转移到胞外蛋白。事实上,在糖基化途径中混合真核和原核糖基转移酶将提供生产糖蛋白治疗剂的最佳途径。用于微生物操作的人乳寡糖的合成鉴于肠道微生物群在人类健康中的关键作用,人们对开发操纵肠道微生物群的方法产生极大兴趣也就不足为奇了。为此,已经开发了使用饮食干预、药物和益生元的方法。碳水化合物代谢和微生物组组成之间的密切联系使得补充碳水化合物成为显而易见的选择。
双歧杆菌在婴儿肠道微生物群中自然富集。人乳含有多种聚糖结构,统称为人乳寡糖(HMOs)。人类缺乏HMO降解所必需的酶。相反,HMO富含有益微生物,主要是能够降解的双歧杆菌。因此,HMO被建议作为婴儿配方奶粉的添加剂,以丰富奶瓶喂养的婴儿的微生物群。然而,与许多膳食多糖不同,HMO不能容易地以工业规模从天然来源获得。商业生产HMO最成功的方法是通过将来自肠道细菌(通常为幽门螺杆菌)的糖基转移酶(和其它酶)掺入用于大规模发酵生产的大型微生物中。以这种方式生产的岩藻糖基乳糖现在被加入到世界范围内的许多婴儿配方奶粉中。
最近的工作强调了糖合成酶技术用于HMO的工业规模合成的潜力。最初的糖苷合成酶概念基本原理依赖于糖苷水解酶催化残基的突变,使其不能降解其天然底物(图5a,b)。当这种灭活的突变体呈现与其天然底物异头构型相反的活化糖基供体时(从而模拟保留糖苷水解酶的共价糖基酶中间体),这些被接受为糖基化反应中的底物,并可形成寡糖和其他糖结合物。与糖基转移酶(用于聚糖合成的天然酶)相比,使用糖合成酶的一个主要优点是它们不需要使用昂贵的核苷酸糖底物。多年来已经开发了许多糖合成酶的变体,但基本原理保持不变。使用糖合成酶的合成路线和选择性(图5c),他们的方法很大程度上依赖于两歧双歧杆菌GH20酶的突变体,这种突变体通常催化HMO的分解。这些酶可以使用容易制备的GlcNAc和LNB的噁唑啉衍生物作为聚糖供体和乳糖作为廉价的聚糖受体。
对于许多药物应用来说,产生抗体和其他治疗性蛋白质的均一的、明确的同型的能力是非常需要的,因为这使得能够评估特定的聚糖结构对生物制药功效、安全性和功能的影响。产生确定的糖型的一种方法包括使用野生型ENGase (GH18或GH85)及其相应的糖合成酶突变体体外改造糖蛋白,所述突变体具有用于选择性组装N聚糖结构的活化底物。首先,使用野生型ENGases进行糖蛋白的去糖基化,在靶蛋白上留下GlcNAc柄。然后可以使用活化的噁唑啉供体,将ENGase糖合成酶突变体用于将N聚糖结构连接到这个残基上,所述供体容易从游离寡糖产生(图5b,d)。来自GH18和GH85家族的细菌糖苷内切酶在聚糖重塑中特别有用,并且已经被用于产生众所周知的治疗性抗体的确定的糖型。
输血是医疗保健系统中不可或缺的一部分,每年可以挽救成千上万人的生命,但是在输血时必须特别注意献血者和受血者的ABO血型。ABO血型系统的基础围绕着附着在红细胞表面的糖蛋白和脂类上的一系列相关碳水化合物。基本结构是H抗原(赋予O型血)的结构,B型和A型抗原通过分别用α半乳糖或α N乙酰半乳糖胺修饰而从该结构衍生而来。O型细胞对绝大多数人来说是非抗原性的,可以捐献给A型、B型或AB型以及O型血的人,因此被称为通用型供体。因此,O型血在紧急情况下特别重要,而且经常供应不足。
使用糖苷酶去除B型和A型血中的α半乳糖或α N乙酰半乳糖胺残基以产生通用的O型供体血是由Goldstein等人在1982年首次提出的,并且在最初的活动中被证明是将B型转化为O型的有用策略。然而,这些研究使用了来自生咖啡豆的低效α半乳糖苷酶,这需要大量的酶来成功地进行血型转换。2007年,当刘等人发现分别作用于A和B抗原的GH109和GH110家族时,取得了实质性的进展。这些酶在比咖啡豆α半乳糖苷酶低得多的酶负载量和更有利的条件下发挥作用。奇怪的是,有人提出GH109s遵循一种非常规的反应机制,类似于首次证明的GH4家族酶的反应机制。在这种机制中,酶使用紧密结合的NAD+辅因子来进行一系列化学步骤(氧化,消除,添加和还原)以实现末端GalNAc的水解(图5e)。
为了确定更适合的酶,我们最近筛选了人类肠道微生物群中能够降解血型的酶。人类肠道的粘液层包含聚糖结构,包括A、B和H抗原。因此,肠道中的细菌似乎很可能产生能够降解血液抗原的酶。这项工作产生了一对高活性的CAZymes--一种碳水化合物酯酶和一种来自黄杆菌的GH36半乳糖胺酶--它们协同作用去除A抗原的末端N乙酰半乳糖胺。这种酶对优于任何以前已知的抗原裂解酶,并可能提供一种更可行的生产通用供体血液的方法。诸如此类的结果进一步强调了人类肠道微生物群中存在的大量有价值的酶活性,并预示着许多有待发现的问题。
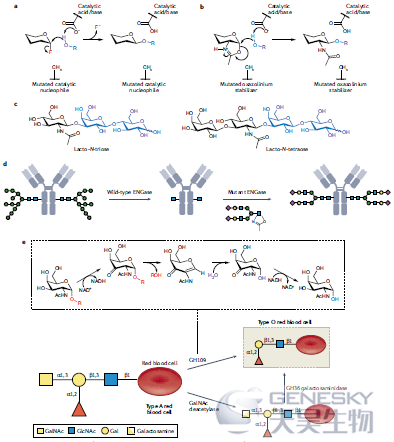
图5、肠道微生物群中酶的应用。a,b)最初由Withers及其同事提出的糖苷合成酶概念(a)和遵循底物辅助机制的酶的适应性(b)。c)人乳低聚糖(HMO)使用双歧杆菌酶按照糖苷合成酶概念生产。d)使用内-β-N-乙酰氨基葡萄糖苷酶(ENGases)改造N-聚糖的一般方案。e )最近使用的两种方法使得碳水化合物活性酶(CAZymes)从A型血生成O型血。
人类肠道微生物群中存在的CAZymes多样性的知识将促进我们对人类和微生物之间的密切关系的理解,并提供对可用于各种目的的酶的新见解。然而,尽管迄今为止的努力,我们才刚刚开始了解人类肠道微生物群中CAZyme的多样性。对碳水化合物在肠道微生物群中如何分配的进一步研究,将为膳食碳水化合物如何影响我们的整体健康提供见解。尽管有大量关于肠道细菌的序列信息,我们仍然不知道大多数基因的功能。未来可以使用超高通量功能筛选方法来对这些酶活性进行分类。这种酶及其工程化的糖合成突变体可被证明有助于调整生物药物的糖基化以提高功效,甚至促进我们对聚糖基本作用的理解。
天昊生物微生物测序相关链接:
咨询沟通请联系
18964693703(微信同号)

创新基因科技,成就科学梦想

 咨询热线:400-065-6886
咨询热线:400-065-6886

 咨询热线:400-065-6886
咨询热线:400-065-6886








